Общая характеристика элементов II А группы. Физические и химические свойства щелочноземельных металлов Ca, Sr, Ba ), их бинарных соединений, гидроксидов и солей
Be, Mg, Ca, Sr, Ba, Ra – элементыII А группы, из них Ca, Sr, Ba, Ra – щелочноземельные металлы, т.к. их гидроксиды обладают щелочными свойствами.
Из всех этих элементов только бериллий – является моноизотопным, все остальные полиизотопны. Радий – единственный элемент этой подгруппы, для которого неизвестно ни одного устойчивого изотопа. Все 14 изотопов радиоактивны и среди них наиболее устойчив 226Ra.
Атомы элементов на внешнем электронном уровне имеют по 2 электрона с противоположными спинами. В возбужденном состоянии один из двух внешних электронов занимает р-орбиталь 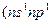 ), за счет чего атомы могут быть двухвалентными.
), за счет чего атомы могут быть двухвалентными.
2s 2p
|
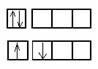
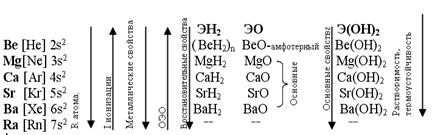
Радиусы атомов их меньше, чем у атомов щелочных металлов, поэтому потенциал ионизации больше. От Be(Mg) к Ra увеличивается радиус атома и иона, в соответствии с этим усиливаются металлические свойства. Причем они менее выражены, чем у щелочных металлов.
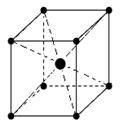
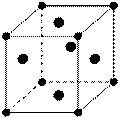
У щелочноземельных металлов – тип металлических структур:Be, Mg – ГПУ (гексагональная плотная упаковка)
Ca, Sr – ГКУ (гранецентрированная кубическая упаковка)
Ba – ОЦКУ (объемно-центрированная кубическая упаковка)
 | |||
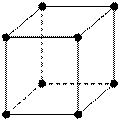 | |||
ГПУ ГКУ ОЦКУ
Температура плавления и кипения бериллия, а также твердость значительно превосходит остальные элементы подгруппы, это связано с тем, что бериллий образует наиболее прочную кристаллическую решетку. Стандартный электродный потенциал уменьшается сверху вниз, соответственно. Восстановительная активность увеличивается от Ве к Ra, но они менее активные восстановители, чем щелочные металлы.
Незакономерное изменение физических свойств: плотности, температуры плавления, температуры кипения обусловлены существенными различиями в строении пространственных кристаллических решеток.
В свободном состоянии это легкие металлы, тверже щелочных, самый мягкий барий, имеют серебристо-белый цвет.
Для элементов II-A группы характерна степень окисления +2, соединения со степенью окисления +1 – неустойчивы.
Все окисляются на воздухе и бериллий, и магний покрываются плотной пленкой оксидов, защищающей их от воздействий. Но остальные металлы взаимодействуют с кислородом воздуха более энергично, поэтому хранят также как и щелочные.
При нагревании все металлы сгорают на воздухе с образованием оксидов.
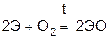
При высоких температурах взаимодействуют с азотом, образуя нитриды.
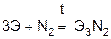
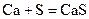
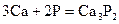
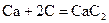
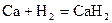
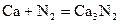
Взаимодействуют с водой, вытесняя водород, все кроме бериллия, магний реагирует медленно и только при высоких температурах, а остальные бурно, т.к. в ряду стандартных электродных потенциалов находятся левее водорода.
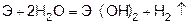
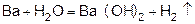
Магний сначала образует оксид, а затем гидроксид.
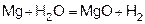
Магний покрыт оксидной плёнкой MgO, который растворяется в H2O при нагревании.
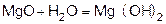
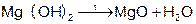
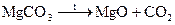
Гидролиз бинарных соединений (при нагревании)
СаS + 2H2O → Ca(OH)2 + H2S↑
Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3↑
CaC2 + 2H2O → Ca(OH)2 + C2H2↑
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3↑
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4↑
Ca, Sr, Ba легко взаимодействуют с водородом, а Be, Mg – не взаимодействуют.
Наряду с обычными оксидами в отличие от Be и Mg образуют пероксиды
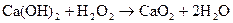
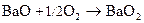
Гидроксиды щелочноземельных металлов – сильные основания (щелочи). Be(OH)2 - aмфолит.
Mg(OH)2 – как основание средней силы хорошо растворяется в кислотах и в растворах солей аммония
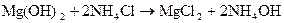 .
.
С ростом ионных радиусов Э2+ в ряду Be-Ba растет растворимость гидроксидов и усиливаются основные свойства в ряду Са(ОН)2 – Sr(OH)2 –Ba(OH)2. Об этом можно судить по значениям 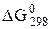 образования ЭСО3 в реакции:
образования ЭСО3 в реакции:
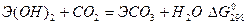
BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
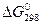 ,кДж/моль 25,1 -38,1 -74,9 -110,0 -128,0
,кДж/моль 25,1 -38,1 -74,9 -110,0 -128,0
Малорастворимые гидроксиды бериллия и магния получают с помощью реакций обмена между солями этих металлов и щелочами.
MgCl2 + 2KOH → Mg(OH)2↓ + 2KCl
Гидроксиды рассматриваемых элементов разлагаются при нагревании.
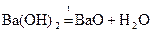
Из разбавленых кислот (кроме HNO3) эти металлы вытесняют водород
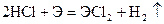
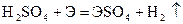 ;
;
разбавленную HNO3 восстанавливают до иона аммония, концентрированную как активные металлы до N2О
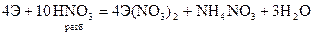
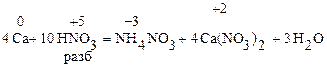
Способы получения
Дата добавления: 2016-01-30; просмотров: 3740;
