Жесткость воды, ее влияние на живые организмы.
В природных водах содержатся соли кальция, например, благодаря растворимости гипса CaSO4×2H2O. В присутствии СО2 растворяются в воде карбонаты кальция и магния
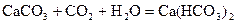
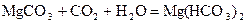
Вода, в которой много растворимых солей Ca и Mg считается жесткой. Жесткость воды выражается числом миллиэквивалентов ионов Са2+ и Mg+2, содержащихся в 1 л Н2О.
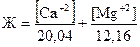 (мг- экв/л),
(мг- экв/л),
где 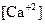 и
и 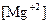 - концентрация Са+2 и Mg+2 (мг-экв/л).
- концентрация Са+2 и Mg+2 (мг-экв/л).
Вода считается мягкой, если в литре воды содержание кальция и магния менее 4 мг-экв/л, средней 4-8, жесткой 8-12, очень жесткой – более 12 мг-экв/л.
В жесткой воде мыло плохо пенится, снижается его моющие действия, т.к. соли Ca и Mg образуют с ним нерастворимые соединения. Мыло – Na-соли высокомолекулярных кислот, натрий замещается на Ca2+и образуется осадок.
В жесткой воде плохо развариваются овощи. У животных нарушается Ca-Mg обмен.
Только растворимые соли Ca и Mg обуславливают жесткость воды. Различают временную и постоянную жесткость воды. Временная (карбонатная) жесткость воды связана с наличием в воде растворимых гидрокарбонатов Ca и Mg. Ее устраняют нагреванием (кипячением).
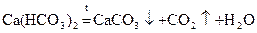
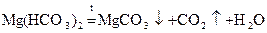
или добавлением известковой воды, фосфатов
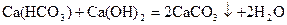 , или
, или
3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2↓ + 3Na2CO3 + 3H2O + 3CO2↑
Устранить жесткость – значит получить нерастворимые соли. При этом образуется накипь СаСO3 и MgCO3. Накипь плохо проводит тепло, вызывает увеличение расхода топлива.
Постоянная жесткость обусловлена наличием в растворе Са и Mg-солей сильных кислот – сульфатов, хлоридов. Кипячением она не устраняется. Постоянная жесткость удаляется добавлением соды и извести
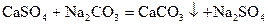
MgSO4 + Ca(OH)2 = Mg(OH)2 + Ca SO4¯
Общая жесткость – сумма временной и постоянной жесткости.
Общую жесткость можно удалить действием соды и известкового молока (содово-известковый способ).
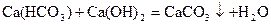
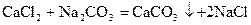 .
.
Все это химические способы устранения жесткости.
Ионы Са2+ и Mg2+ можно удалить из воды посредством катионитов (ионообменных смол), сложных веществ, нерастворимых в воде, способных обменивать свои катионы.
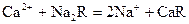 (R – сложный кислотный остаток)
(R – сложный кислотный остаток)
Ионы Са2+ и Mg2+ из воды переходят в катиониты.
Для восстановления катионита, его промывают концентрированным раствором NaCl, катионит потом снова можно использовать для очистки воды.
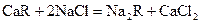
Дата добавления: 2016-01-30; просмотров: 2734;
