Особенности бериллия
Также как литий отличается от элементов I-A группы, Be – отличается от элементов II-А группы.
Атом Ве имеет на предвнешнем электронном уровне только два электрона, в отличие от остальных элементов II-A группы, у которых их по 8. У него наименьший радиус. Поэтому Ве проявляет диагональное сходство с Al.
Ве и его аналоги при нагревании с галогенами образуют галогениды ЭГ2. Их получают также действуя НГ на металл или на Э(ОН)2.
Be + Cl2 → BeCl2
ЭГ2 – кристаллические вещества.
В молекуле BeCl2 в наружном слое 4 электрона. Ве – может быть акцептором электронных пар и образовывает две связи по донорно-акцепторному механизму. Cl – донор электронной пары.
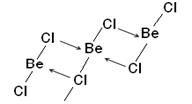
В итоге при конденсации BeCl2 образуются линейные полимерные цепи. Бериллий образует бинарные соединения:
Be + O2 = 2BeO
Be + S 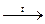 BeS
BeS
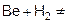
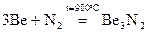
и разлагаются водой
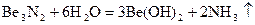
В обычных условиях бериллий не образует простых ионов, как и для алюминия, для него характерны катионные и анионные комплексы, где координационное число Be равно 4 (Кч.Be = 4); в водных растворах не существует иона Be2+ так как он гидратирован.
Также как и алюминий бериллий обладает амфотерными свойствами, растворяется и в кислотах и в щелочах
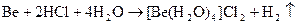
Be + 2H+ + 4H2O = [Be(H2O)4]2+ + H2↑
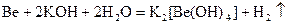
Be + 2OH- + 2H2O = [Be(OH)4]2- + H2↑
Be пассивируется концентрированной азотной и серной кислотами, но при нагревании реагируют с этими кислотами:
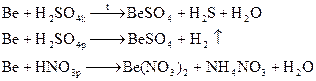
Амфотерный оксид Ве взаимодействует при сплавлении как с кислотными так и с основными оксидами.
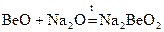 (бериллат натрия)
(бериллат натрия)
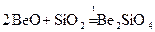 (ортосиликат бериллия).
(ортосиликат бериллия).
Как и оксид, амфотерны сульфиды и галогениды бериллия.
BeS + Na2S → Na2BeS2
Кис. осн.
BeS + SiS2 → Be2[SiS4]
Осн. кис.
BeF2 + NaF → Na2[BeF4]
Кис. осн.
BeF2 + SiF4 → Be[SiF6]
Осн. кис.
Амфотерен и гидроксид бериллия
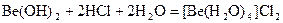
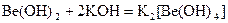
Соль бериллия, образованную слабой кислотой, можно получить только непосредственно соединением элементов, но нельзя получить смешиванием водных растворов, так как идет совместный гидролиз солей.
Все соединения Ве токсичны. С учетом особенностей его свойств, применяется в атомной технике, электронике.
Дата добавления: 2016-01-30; просмотров: 1709;
