Особенности лития и его соединений
Литий существенно отличается от остальных элементов IA группы. Особые свойства характерны для всех элементов II периода. В отличие от остальных ионов щелочных металлов, у которых по 8 электронов на предвнешнем уровне ион Li+ имеет только 2 электрона. У лития на кайносимметричной 2р-орбитали нет еще ни одного электрона.
Связь лития с другими элементами имеет менее ионный характер, что приближает его к магнию (диагональное сходство элементов в периодической системе). В периодической системе только у 2-го или даже 3-го элемента А групп полностью проявляются характерные свойства. Аномальное поведение Li заключается в том, что у Li самое отрицательное значение электродного потенциала и можно ожидать, что Li поэтому должен быть самым активным из всех металлов. Но это не так. По активности он близок к Mg, Ca.
Поэтому низкое значение электродного потенциала объясняется тем, что у Li самая высокая энергия гидратации из-за малого размера атома. Такая закономерность справедлива лишь для всех водных растворов. По химическим свойствам Li отличается от щелочных металлов, как и его соединения.
Подобно соединениям магния малорастворимы в воде LiF, Li2CO3, Li3PO4. LiOH менее других растворим в воде.
Li взаимодействует с азотом Li3N,
6Li + N2 → 2Li3N-3 (нитрид лития),
с кремнием − Li4Si,
4Li + Si → Li4Si (силицид лития)
с углеродом – Li2С2,
2Li + 2C = 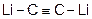 (ацетиленид лития)
(ацетиленид лития)
с водородом − LiH,
2Li + H2 → 2LiH (гидрид лития)
с кислородом − Li2O
4Li + O2 → 2Li2O (оксид лития)
Гидроксиды МеОН, за исключением LiOH выдерживают нагревание до более 1000°С, LiOH разлагается при температуре красного каления (550 – 6000С).
Кислородосодержащие соединения (LiOH, LiNO3, Li2CO3) при нагревании разлагаются.
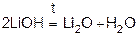
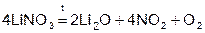
Li2CO3 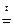 Li2O + CO2↑
Li2O + CO2↑
Малый радиус иона Li+ обусловливает возможность координации лигандов вокруг этого иона, образование большого числа двойных солей, различных сольватов, высокую растворимость ряда солей лития в органических растворителях (подобно магнию).
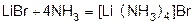
Аналогию в свойствах соединений лития и магния можно объяснить близостью величин их ионных радиусов
r (Li+) = 0,068 нм, r (Mg+2) = 0,074 нм.
Дата добавления: 2016-01-30; просмотров: 11118;
