С увеличением порядкового номера, уменьшается относительная электроотрицательность (ОЭО).
Все щелочные металлы образуют одинаковую кристаллическую структуру. У щелочных металлов тип металлической структуры – объемно - центрированная кубическая упаковка (ОЦКУ).
|
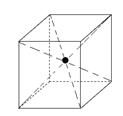
От Li к Cs увеличиваются размеры атомов и межъядерные расстояния в кристаллических решетках. Так как химическая связь большей длины является менее прочной, то по мере роста межъядерного расстояния уменьшается прочность кристаллических решеток, поэтому снижаются температуры плавления и кипения. Щелочные металлы активно окисляются кислородом воздуха при обычной температуре, поэтому их хранят под слоем керосина или бензина.
4Э + О2 = 2Э2О
Взаимодействуют с другими окислителями (галогенами, серой, фосфором), образуя соединения LiCl, Li2S, Li3P, NaBr, Na2S.
С азотом взаимодействует только литий при обычной температуре.
6Li + N 2 = 2Li3N
Нагревая щелочной литий в струе газообразного водорода получают гидрид.
2Li + Н2 = 2LiH-.
С кислородом образуют оксиды, пероксиды, надпероксиды, озониды.
4Li + O2 → 2Li2O– оксид лития
2Na + O2 → Na2O2 – пероксид натрия
K + O2 → KO2 – надпероксид (супероксид калия)
Пероксиды содержат диамагнитный ион О22-, надпероксиды– парамагнитный ион О2-.
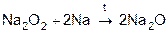
Оксиды Na и K могут получиться при недостатке кислорода. Элементы могут образовывать озониды по реакции с озоном:
K + O3 → KO3
KOH + O3 → KO3 + O2 + H2O
Все озониды, пероксиды, надпероксиды сильные окислители и разлагаются водой.
 KO2 + H2O → KOH + O2 + H2O2
KO2 + H2O → KOH + O2 + H2O2
KO2 + H2O(теплая) → KOH + O2
КО3 + H2O → KOH + O2
Причем разложение может идти как обменное взаимодействие.
Na2O2 + 2H2O → 2NaOH + H2O2
Оксиды щелочных металлов Ме2О – кристаллические термически устойчивые вещества, при взаимодействии с водой образуют щелочи.
Ме2О + Н2О = 2МеОH
 Ме2O + H2O → 2MeOHлабораторные способы
Ме2O + H2O → 2MeOHлабораторные способы
2Na + 2H2O → 2NaOH + H2↑ получения щелочей
карбонатный способ получения щелочей:
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
В промышленности NaOH получают электролизом раствора поваренной соли:
NaCl + H2O электролиз → NaOH + Cl2 + H2
K ( - ) 2H2O + 2e = H2 + 2OH-
A ( + ) 2Cl- - 2e = Cl2
Этим способом получают достаточно чистый NaOH.
Оксиды и гидроксиды
| Li2O Na2O K2O Rb2O Cs2O Fr2O | растворимость | LiOH
NaOH
KOH
RbOH
CsOH
FrOH | сила оснований |
Гидроксиды щелочных металлов МеОН – твердые кристаллические вещества, легкоплавки, хорошо растворяются в воде с выделением тепла (кроме LiOH), полностью диссоциируют на ионы, сила оснований растет от Li к Fr.
ЭОH ® Э+ + OH-
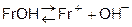
Более активно реагируют с водой непосредственно щелочные металлы.
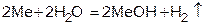
Интенсивность взаимодействия с водой увеличивается в ряду Li - Cs, Rb и Cs реагируют с Н2О со взрывом.
Дата добавления: 2016-01-30; просмотров: 1396;


