Зависимость коэффициента активности от ионной силы раствора
Средний коэффициент активности бинарного z+, z- -валентного
электролита можно рассчитать по выведенному Дебаем и Хюккелем уравнению
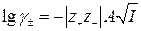 , (1.15)
, (1.15)
где I – ионная сила раствора; 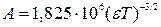 ,
,
где 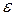 – диэлектрическая проницаемость растворителя.
– диэлектрическая проницаемость растворителя.
В разбавленном водном растворе при 298 К 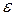 =78,3 и А = 0,509.
=78,3 и А = 0,509.
Уравнение (1.15) применимо только к сильно разбавленным электролитам и называется предельным законом Дебая – Хюккеля. Этот закон формулируется следующим образом.
При данной ионной силе раствора средний коэффициент активности электролита в предельно разбавленном растворе является величиной постоянной и не зависит от природы других электролитов в растворе.
Таким образом, в предельном законе Дебая –Хюккеля получает теоретическое обоснование правило ионной силы. Закон устанавливает линейную зависимость 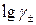 от
от 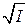 . Однако, этот закон соблюдается лишь в растворах с ионной силой порядка 10-2 и меньше.
. Однако, этот закон соблюдается лишь в растворах с ионной силой порядка 10-2 и меньше.
С ростом концентрации раствора электролита, отклонения опытных значений 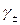 от вычисленных по уравнению (1.15) увеличиваются.
от вычисленных по уравнению (1.15) увеличиваются.
Для растворов с ионной силой до 0,1 справедливо уравнение
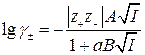 , (1.16)
, (1.16)
где В – теоретический коэффициент, равный для водных растворов при 298 К В = 0,33 · 108;
а – средний эффективный диаметр ионов, находят из опыта. По порядку величины он близок к размеру ионов (10-8 см).
Удовлетворительное согласие с опытом в широком интервале концентраций растворов электролитов для расчета среднего коэффициента активности дает полуэмпирическое уравнение
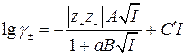 . (1.17)
. (1.17)
Слагаемое 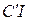 вводится для учета поляризации дипольных молекул растворителя вокруг иона растворенного вещества, что равноценно уменьшению диэлектрической проницаемости вблизи иона, а также для учета размеров сольватных оболочек ионов. Постоянный коэффициент
вводится для учета поляризации дипольных молекул растворителя вокруг иона растворенного вещества, что равноценно уменьшению диэлектрической проницаемости вблизи иона, а также для учета размеров сольватных оболочек ионов. Постоянный коэффициент 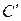 подбирается опытным путем.
подбирается опытным путем.
К сожалению, до сих пор еще не существует достаточно строгой теории, которая бы позволила рассчитать в согласии с опытом зависимость среднего коэффициента активности ионов электролита от концентрации в области концентрированных растворов.
Дата добавления: 2016-01-09; просмотров: 2601;
