Средняя ионная активность и средний коэффициент активности
Термодинамика растворов электролитов
Основные понятия
Электрохимия - раздел физической химии, в котором изучаются законы взаимного превращения химической и электрической форм энергии, а также системы, где эти превращения совершаются. В электрохимии также изучаются физико-химические свойства ионных проводников, процессы и явления на границах раздела фаз с участием заряженных частиц - ионов и электронов.
Все проводники электрического тока можно разделить на электронные и ионные. Электронные проводники (проводники I рода) переносят электрический ток движением электронов. Ионные проводники (проводники II рода) проводят электрический ток за счет перемещения ионов.
Электролитаминазываются вещества (химические соединения), которые в растворе или в расплаве самопроизвольно частично или полностью распадаются на ионы - заряженные частицы, способные к самостоятельному существованию. Перенос электричества в растворах электролитов осуществляется ионами, т.е. электролиты - это проводники II рода. Электролиты бывают как твердыми, так и жидкими. Число ионов каждого знака, образующихся при распаде электролита, определяется стехиометрическими коэффициентами в уравнении химической реакции диссоциации этого электролита:
Мn+Аn- = n+ Мz+ + n- Аz-, (1.1)
где n+, n - и n = n+ + n- - число катионов, число анионов и общее число заряженных частиц в электролите. Несмотря на наличие ионов, раствор электролита остаётся электронейтральным.
Процесс распада растворенного вещества в растворе на ионы называется электролитической диссоциацией.
О том, что электролиты распадаются (диссоциируют) при растворении свидетельствуют многие явления, обнаруженные многими исследователями при изучении растворов электролитов. Было установлено, что осмотическое давление 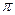 , понижение парциального давления пара жидкости над раствором
, понижение парциального давления пара жидкости над раствором 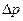 , понижение температуры замерзания
, понижение температуры замерзания 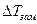 и некоторые другие свойства имеют большее значение для растворов электролитов, чем для эквимолекулярных растворов неэлектролитов. Все эти величины зависят в первую очередь от числа частиц растворенного вещества в единице объема раствора (коллигативные свойства). Поэтому, как указывал Вант – Гофф, их повышенное значение для растворов электролитов следует объяснить увеличением числа частиц в результате диссоциации растворенного вещества на ионы.
и некоторые другие свойства имеют большее значение для растворов электролитов, чем для эквимолекулярных растворов неэлектролитов. Все эти величины зависят в первую очередь от числа частиц растворенного вещества в единице объема раствора (коллигативные свойства). Поэтому, как указывал Вант – Гофф, их повышенное значение для растворов электролитов следует объяснить увеличением числа частиц в результате диссоциации растворенного вещества на ионы.
Для формальной оценки этих отклонений Вант-Гоффом был предложен изотонический коэффициент 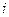 :
:
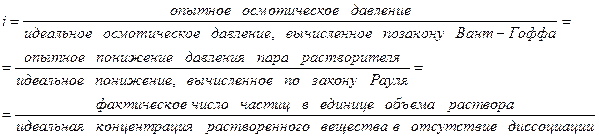
Тогда, для растворов электролитов:
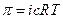 ;
; 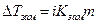 ;
; 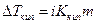 .
.
_____________________________________________________________________
Классическая теория электролитической диссоциации была создана Аррениусом в 1887 году. Она предполагала, что не все молекулы электролита в растворе распадаются на ионы. Отношение числа диссоциированных молекул к исходному числу недиссоциированных молекул электролита (доля распавшихся молекул) в состоянии равновесия называется степенью диссоциации a, причем0£ a £ 1. С уменьшением концентрации раствора степень диссоциации электролита возрастает и в бесконечно разбавленном растворе a = 1 для всех электролитов. Степень диссоциации зависит также от природы электролита и растворителя, температуры и присутствия других электролитов в растворе.
Чем выше диэлектрическая проницаемость растворителя, тем больше степень диссоциации электролита (приближенное правило Каблукова-Нернста-Томсона).
Степень диссоциации и изотонический коэффициент связаны между собой уравнением 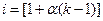 , где k – число ионов, на которые распадается электролит.
, где k – число ионов, на которые распадается электролит.
В зависимости от степени диссоциации, электролиты подразделяют на сильные (a > 0,8) и слабые (a < 0,3). Иногда выделяют группу электролитов средней силы. В водных растворах сильными электролитами являются многие минеральные кислоты (HNO3, HCl, HClO4 и др.), основания (NaOH, KOH, и др.), большинство солей (NaCl, K2SO4 и др.).
К слабым электролитам относятся вещества, которые в растворах распадаются на ионы лишь частично. В водных растворах слабыми электролитами являются некоторые неорганические кислоты (H2CO3, H3BO3 и др.), основания (NH4ОН и др.), некоторые соли (HgCl2 и др.), большинство органических кислот (CH3COOH, C6H5COOH и др.), фенолы (C6H4(OH)2 и др.), амины (C6H5NH2 и др.). Так как сила электролита зависит от природы растворителя, то одно и то же вещество в одном растворителе может быть сильным электролитом (например, NaCI - в воде), а в другом - слабым (например, NaCI в нитробензоле).
Величина a не удобна для характеристики электролита, так как она зависит от концентрации. Более удобной характеристикой способности электролита к диссоциации является константа диссоциации (Кдисс ), поскольку равновесие между ионами и молекулами подчиняется закону действующих масс. Так, для одно-одновалентного электролита АВ, диссоциирующего в растворе на ионы по схеме AB = A+ + В-, выражение для константы электролитической диссоциации Кдисс имеет вид:
Кдисс = 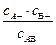 . (1.2)
. (1.2)
Константа диссоциации зависит от природы растворителя и температуры, но не зависит от концентрации электролита в растворе.
Если с - начальная концентрация электролита АВ, а степень его диссоциации равна 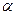 , то, согласно уравнению реакции диссоциации этого электролита, в состоянии равновесия концентрация катионов и анионов будет равна:
, то, согласно уравнению реакции диссоциации этого электролита, в состоянии равновесия концентрация катионов и анионов будет равна:
сА+ = сВ-= a×с .
Концентрация не распавшихся молекул электролита станет равной
с(1 – a).
Подставляя эти соотношения в уравнение (1.2), получаем:
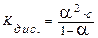 . (1.3)
. (1.3)
При диссоциации электролита 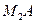 по реакции
по реакции 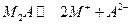 образуется два катиона и один анион и
образуется два катиона и один анион и 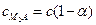 ;
; 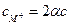 ;
; 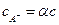 . Тогда
. Тогда
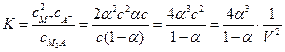 . (1.3,а)
. (1.3,а)
Для данного электролита, диссоциирующего на ионы в данном растворителе, при данной температуре, константа диссоциации есть величина постоянная, не зависящая от концентрации раствора электролита.
Полученные уравнения, называемые законом разведения Оствальда, позволяют оценить степень диссоциации электролита.
При небольших значениях a, т.е. для слабых электролитов, можно принять, что
(1 – a) @ 1. Тогдa, выражение (1.3) переходит в
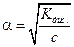 . (1.4)
. (1.4)
Как видно, степень диссоциации обратно пропорциональна корню квадратному из концентрации электролита. При уменьшении концентрации электролита, например, в 100 раз, степень диссоциации возрастает в 10 раз.
Влияние температуры на степень диссоциации обусловлено тем, что константа диссоциации зависит от температуры (уравнение изобары химической реакции).
Введение посторонних ионов в раствор обычно увеличивает степень диссоциации слабого электролита. Это явление называется солевым эффектом.
Теория Аррениуса позволяет качественно и количественно описывать явления, связанные с ионными равновесиями. Однако эта теория не учитывает взаимодействия ионов с диполями растворителя и ион – ионного взаимодействия.
Выражения (1.2 - 1.4) применимы для идеальных растворов. Свойства растворов реальных электролитов существенно отличаются от свойств идеальных растворов. Это объясняется увеличением числа частиц в растворе электролита (за счёт диссоциации) и электростатическим взаимодействием между ионами. Свойства реальных растворов можно описать, используя вместо концентрации активность. Активность(a) - величина, которую надо подставить в выражение для химического потенциала идеального раствора для того, чтобы получить значение химического потенциала реального раствора электролита.
Активность связана с концентрацией следующим соотношением: 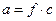 , (
, ( 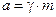 ), где
), где 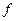 (
( 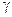 )- коэффициент активности, учитывающий отклонение свойств реальных растворов электролитов от свойств идеальных растворов, c и m – молярная и моляльная концентрации.
)- коэффициент активности, учитывающий отклонение свойств реальных растворов электролитов от свойств идеальных растворов, c и m – молярная и моляльная концентрации.
Таким образом, вместо выражения (2) получают:
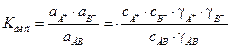 , (1.5)
, (1.5)
где ai = сi×gi ; сi ; g i - активность, концентрация и коэффициент активности отдельного иона или молекулы.
Средняя ионная активность и средний коэффициент активности
Использование активности вместо концентрации ионов позволяет формально учесть всю совокупность взаимодействий (без учета их физической природы), возникающих в растворах электролитов. Этот способ описания взаимодействий применительно к растворам электролитов имеет ряд особенностей.
Химический потенциал растворяемой соли (mS) равен:
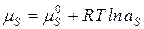 , (1.6)
, (1.6)
где aS - активность соли; mS0 - стандартное значение химического потенциала, отвечающее aS =1.
Если электролит диссоциирует на n+ катионов и n- анионов, то, исходя из условия электронейтральности, химический потенциал соли связан с химическими потенциалами катионов и анионов соотношением:
mS = n+ m+ + n- m--; mS0 = n+ m+0+ n- m--0; (1.7)
Химический потенциал иона связан с активностью иона соотношением:
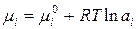 , (1.8)
, (1.8)
где mi - химический потенциал катиона или аниона.
Из уравнений (1.5-1.7) следует, что:
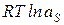 = n+
= n+ 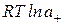 + n-
+ n- 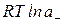 , (1.9)
, (1.9)
или
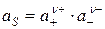 . (1.10)
. (1.10)
В связи с тем, что в растворах электролитов одновременно присутствуют и катионы, и анионы растворенного вещества (получить раствор, содержащий только катионы или анионы, невозможно), оценить активность и коэффициент активности отдельного иона невозможно. Поэтому для растворов электролитов вводятся понятия средней ионной активности и среднего ионного коэффициента активности.
Для электролита, который диссоциирует на n+ катионов и n- анионов средняя ионная активность электролита a± равна среднему геометрическому из произведения активностей катиона и аниона:
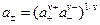 , (1.11)
, (1.11)
где a+ и a- – активность катионов и анионов соответственно ; n = n+ + n- - общее число ионов, образующихся при диссоциации молекулы электролита.
Например, для раствора Cu(NO3)2:
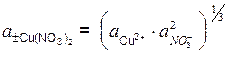 .
.
Аналогично рассчитывается средний коэффициент активности электролита g± и среднее число ионов электролита в растворе n±:
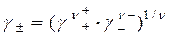 ; (1.12)
; (1.12)
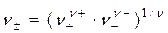 , (1.13)
, (1.13)
где 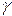 + и
+ и 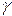 - - коэффициенты активности катиона и аниона; n± - среднее число катионов и анионов в растворе.
- - коэффициенты активности катиона и аниона; n± - среднее число катионов и анионов в растворе.
Например, для электролита KCI=K+ + CI- среднее число ионов в растворе равно n± = (11·11)1 = 1, то есть в растворе KCI один катион и один анион. Для электролита Al2(SO4)3= 2Al3+ + 3SO42- среднее число ионов в растворе равно n± = (22·33)1/5=2,56. Это означает, что в расчетах средней активности будет фигурировать одинаковое среднее число катионов и анионов (2,56), отличное от действительного (катионов 2, анионов 3).
Обычно среднюю ионную активность и средний ионный коэффициент активности определяют экспериментально (по термодинамическим свойствам растворов):
- по повышению температуры кипения раствора;
- по понижению температуры замерзания раствора;
- по давлению пара растворителя над раствором;
- по растворимости малорастворимых соединений,
- по методу ЭДС гальванических элементов и др.
Среднюю ионную активность и средний ионный коэффициент активности электролита для разбавленных растворов сильных электролитов можно определить теоретически по методу Дебая-Хюккеля.
Средняя ионная активность и средний ионный коэффициент активности зависят не только от концентрации раствора, но и от заряда иона. В области низких концентраций средний ионный коэффициент активности определяется зарядом образующих ионов и не зависит от других свойств электролитов. Например, в области низких концентраций g± для растворов KСl, NaNO3, HСl и др. одинаковы.
В разбавленных растворах сильных электролитов средний коэффициент активности g± зависит от общей концентрации всех присутствующих в растворе электролитов и зарядов ионов, т.е. g± зависит от ионной силы раствора I. Ионная сила раствора рассчитывается по формуле:
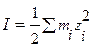 , (1.14)
, (1.14)
где mi –моляльная (или молярная) концентрация i- того иона; zi - заряд иона. При расчёте ионной силы раствора необходимо учитывать все ионы, находящиеся в растворе.
Существует правило ионной силы раствора: в разбавленных растворах коэффициент активности сильного электролита одинаков для всех растворов с одной и той же ионной силой независимо от природы электролита. Это правило справедливо при концентрациях не более 0,02 моль/дм3. В растворах средних и высоких концентраций правило ионной силы трансформируется, так как усложняется характер межионного взаимодействия и проявляются индивидуальные свойства электролитов.
Дата добавления: 2016-01-09; просмотров: 17099;
