Удельная электрическая проводимость растворов электролитов
Так как в растворах электролитов присутствуют заряженные частицы, то, при наложении электрического поля, растворы электролитов способны проводить электрический ток. Способность растворов электролитов проводить электрический ток обеспечивается за счет миграции ионов, присутствующих в данном растворе.
Мерой способности веществ проводить электрический ток является удельная электрическая проводимостьæ — величина, обратная удельному электрическому сопротивлению:
æ 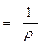 . (2.1)
. (2.1)
Так как
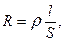 то æ
то æ 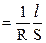 , (2.2)
, (2.2)
где r -удельное электрическое сопротивление, Ом×м; S - поперечное сечение, м2; 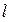 - длина проводника, м; æ - удельная электрическая проводимость, Ом–1м–1=См·м–1 (Ом–1 = См - Сименс).
- длина проводника, м; æ - удельная электрическая проводимость, Ом–1м–1=См·м–1 (Ом–1 = См - Сименс).
Удельная электрическая проводимостьраствора электролита - это электрическая проводимость раствора электролита, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и находящимися на расстоянии 1 м друг от друга.
Электропроводность растворов электролитов зависит в первую очередь от природы электролита и растворителя и является функцией следующих факторов:
* концентрации ионов;
* скорости их движения, которая зависит от заряда и радиусов сольватированных ионов;
* вязкости и диэлектрической постоянной растворителя;
* температуры.
Удельная электрическая проводимость раствора электролита определяется количеством ионов, переносящих электричество, и скоростью их миграции.
Зависимость удельной электрической проводимости растворов некоторых электролитов от концентрации представлена на рис.1.
В разбавленных растворах сильных и слабых электролитов рост электрической проводимости с концентрацией обусловлен увеличением числа ионов, переносящих электричество. В области концентрированных растворов повышение концентрации сопровождается увеличением вязкости растворов, что снижает скорость движения ионов и электрическую проводимость.
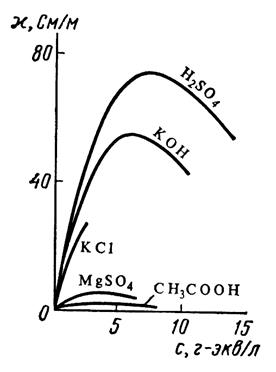 Рис.1. Зависимость удельной электрической проводимости растворов различных электролитов от концентрации: KCl, KOH, H2SO4 -сильные электролиты, CH3COOH, MgSO4– слабые электролиты. Рис.1. Зависимость удельной электрической проводимости растворов различных электролитов от концентрации: KCl, KOH, H2SO4 -сильные электролиты, CH3COOH, MgSO4– слабые электролиты.
|
Торможение движения ионов в электрическом поле для сильных электролитов обусловлено также тормозящими эффектами: электрофоретическим (торможение движения заряженных ионов полярными молекулами растворителя) и релаксационным (торможение движения ионов в электрическом поле ионами противоположного знака). У слабых электролитов в концентрированных растворах заметно снижается степeнь диссоциации и, следовательно, число ионов, переносящих электричество.
При повышении температуры электролита возрастают скорость движения ионов и удельная электрическая проводимость:
æ2= æ1 [1+b(Т2 – Т1)], (2.3)
где b - температурный коэффициент электрической проводимости (для сильных кислот – 0,016, для сильных оснований – 0,019 и для солей – 0,022).
Дата добавления: 2016-01-09; просмотров: 3484;
