Адсорбция сильных электролитов: избирательная, ионообменная. Правило Панета-Фаянса. Иониты, их применение в медицине
Адсорбция электролитов требует специального рассмотрения, так как адсорбент, имеющий различные по активности функциональные группы, может по различному адсорбировать малые по размеру ионы, на которые диссоциируют молекулы низкомолекулярных веществ в растворе. Ионы электролита в растворе являются носителями электрического заряда, поэтому при переходе ионов из объемной фазы на твердую поверхность в результате адсорбции происходит перераспределение зарядов и возникновение двойного электрического поля (ДЭС) в области поверхностного слоя. Исходя из электронейтральности адсорбции ионов, перенос ионов из объема к поверхности происходит только как электронейтральное объединение нескольких ионов, не сопровождающееся каким-либо изменением заряда. Поэтому (ДЭС) всегда электронейтрален и раствор, в котором произошла адсорбция ионов.
Электрохимический процесс образования ДЭС безусловно является адсорбционным, так как концентрация ионов в поверхностном слое меняется. При этом следует выделить две возможности процесса перехода ионов на поверхность:
1) из раствора электролита на поверхность твердой фазы для уравнивания поверхностного натяжения на границе раздела - адсорбция
2) из твердой фазы в жидкую, что приводит к адсорбции растворителя и сольватации ионогенных групп твердой фазы – поверхностная диссоциация.
Избирательная адсорбция ионов зависит от его валентности, радиуса, степени сольватации. По способности адсорбироваться катионы и анионы располагают в так называемые лиотропные ряды.
Если вещество твердой фазы обменивается с раствором анионами, его называют анионитом, если катионами - катионитом. Общее название этих веществ - иониты.
Схема анионного обмена:
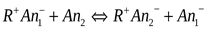 (50)
(50)
Схема катионного обмена:
 (
(
Количественно обмен ионов на твердой фазе в состоянии равновесия характеризует уравнение Б. П. Никольского:
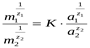
где m1, m2 - содержание обменивающихся ионов в адсорбенте, a1, а2 - активности обменивающихся ионов в растворе z - заряд ионов, К - константа ионного обмена.
Правило Фаянса — Панета — правило, эмпирически установленное К.Фаянсом и Ф.Панетом (1913), согласно которомурадиоактивный изотоп, присутствующий в растворе в микроконцентрациях в форме катиона, тем сильнее сорбируетсявыпадающим или заранее полученным осадком, чем меньше растворимость соединения, которое образует этот катион санионом осадка. Правило Фаянса — Панета применимо при соосаждении в радиохимии.
Иная формулировка этого правила (также называемая правилом Фаянса — Пескова — Панета) гласит о том, что на поверхности твёрдого вещества преимущественно адсорбируются ионы, которые могут достраивать кристаллическую решётку, то есть входят в её состав, изоморфны или образуют труднорастворимое соединение с ионами, составляющими кристаллическую решётку. Эта формулировка применяется для определении знака заряда поверхности при образовании ДЭС вколлоидной химии.[1]
Дата добавления: 2016-01-16; просмотров: 9109;
