Скорость химических реакций. Раздел химии, изучающий скорости и механизмы химических реакций, называется химической кинетикой.
Раздел химии, изучающий скорости и механизмы химических реакций, называется химической кинетикой.
Химические реакции протекают с различными скоростями. Некоторые из них заканчиваются за секунды, другие - за минуты, часы, дни; некоторые для своего протекания требуют десятилетий. Кроме того, одна и та же реакция может протекать быстро при повышенных температурах и медленно – при охлаждении.
Знание скоростей химических реакций имеет большое значение, так как определяет размеры и производительность аппаратуры, количество получаемого продукта. На практике важно знать, как изменить условия, чтобы реакция протекала с требуемой скоростью.
Скорость химической реакции–это изменение количества реагирующего вещества или продукта реакции за единицу времени в единице объема (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции).
Гомогенной называется реакция, протекающая в однородной среде (в одной фазе). Гетерогенные реакции протекают на границе раздела фаз, например твердой и жидкой, твердой и газообразной. Отношение количества вещества к единице объема называется концентрацией с, моль/л.
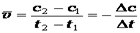 Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна:
Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна:
,
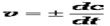 где с2и с1 – концентрации исходного вещества в момент времени t2 и t1.
где с2и с1 – концентрации исходного вещества в момент времени t2 и t1.
Знак минус означает, что концентрация исходного вещества уменьшается. В ходе реакции изменяются концентрации реагирующих веществ и соответственно скорость реакции. Скорость реакции в данный момент времени или, мгновенная (истинная) скорость реакции, равна:Скорость реакции принимается всегда положительной, поэтому производная исходных концентраций берется со знаком минус, а продуктов реакции – со знаком плюс.
Скорость реакции имеет единицу измерения [моль м-3 с-1], [моль л-1с-1].
Скорость реакции зависит от природы реагирующих веществ. Некоторые реакции протекают со взрывом, другие могут идти годами. На скорость реакции влияют такие факторы как концентрация веществ, температура, катализаторы.
Дата добавления: 2016-01-16; просмотров: 2329;
