Хроматография, ее сущность и применение в биологии и медицине.
Хроматогра́фия (от др.-греч. χρῶμα — цвет) — динамический сорбционный метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами — неподвижной (твердая фаза или жидкость, связанная на инертном носителе) и подвижной (газовая или жидкая фаза, элюент). Название метода связано с первыми экспериментами по хроматографии, в ходе которых разработчик метода Михаил Цвет разделял ярко окрашенные растительные пигменты.
Метод хроматографии был впервые применён русским учёным-ботаником Михаилом Семеновичем Цветом в 1900 году.
Существуют различные способы классификации хроматографических методов.
1. По физической природе неподвижной и подвижной фаз.
2. Жидкостная хроматография ЖХ (если подвижная фаза жидкая) и газовая хроматография ГХ (если подвижная фаза газообразная).
Жидкостную хроматографию в свою очередь можно разделить в зависимости от агрегатного состояния неподвижной фазы на твердо-жидкофазную (ТЖХ) — неподвижная фаза твердая и жидко-жидкофазную хроматографию (ЖЖХ) — неподвижная фаза жидкая. ЖЖХ часто называют распределительной хроматографией. Газовую хроматографию в зависимости от агрегатного состояния неподвижной фазы делят на газоадсорбционную (ГТХ, ГАХ) и газожидкостную (ГЖХ) или газораспределительную.
В зависимости от способа перемещения сорбатов вдоль слоя сорбента различают проявительный (элюентный), фронтальный, вытеснительный методы и электрохроматографию. При использовании проявительного метода пробу исследуемой смеси вводят порцией в начальной точке (вход в колонку) на слой хроматографической насадки (сорбента). Под действием потока подвижной фазы зона пробы начинает перемещаться вдоль колонки, причем скорости перемещения отдельных компонентов пробы обратно пропорциональны величинам соответствующих им констант распределения.
В методе фронтальной хроматографии разделяемая смесь непрерывно поступает на слой сорбента в начальной точке и, таким образом, фактически играет роль подвижной фазы. Методика проведения разделения вытеснителъным методом аналогична методике проведения разделения проявительным методом, но без использования несорбирующегося элюента (подвижной фазы). Перемещение хроматографических зон достигается путем вытеснения компонентов разделяемой смеси веществом, которое сорбирует сильнее любого из этих компонентов. Каждый компонент этой пробы вытесняет компоненты, которые взаимодействуют с неподвижной фазой менее сильно, чем он сам. Для аналитических целей наиболее широко используется элюентный (проявительный) метод хроматографирования. Электрохроматография — хроматографический процесс, при котором движение заряженных частиц осуществляется под действием приложенного напряжения. Скорость движения частиц определяется их массой и зарядом.В зависимости от природы процесса, обусловливающего распределение сорбатов между подвижной и неподвижной фазами, различают адсорбционную, распределительную, ионообменную, осадочную, аффинную и эксклюзионную хроматографию.
К хемосорбционной хроматографии относят осадочную, комплексообразовательную (или лигандообменную), окислительно-восстановительную. Причиной сорбции в хемосорбционной хроматографии являются соответствующие химические реакции.
По технике выполнения (характеру процесса) различают: колоночную хроматографию (неподвижная фаза находится в колонке); плоскостную (планарную) — бумажную и тонкослойную (неподвижная фаза — лист бумаги или тонкий слой сорбента на стеклянной или металлической пластинке); капиллярную хроматографию (разделение происходит в пленке жидкости или слое сорбента, размещенном на внутренней стенке трубки); хроматографию в полях (электрических, магнитных, центробежных и других сил).
В зависимости от цели проведения хроматографического процесса различают аналитическую, неаналитическую, препаративную и промышленную хроматографию.Аналитическая хроматография предназначена для определения качественного и количественного состава исследуемой смеси.
Неаналитическая хроматография — метод исследования физико-химических характеристик веществ при использовании хроматографической аппаратуры и на основании параметров хроматографических зон.
По агрегатному состоянию фазГазовая хроматографияГазо-жидкостная хроматографияГазо-твёрдофазная хроматографияЖидкостная хроматографияЖидкостно-жидкостная хроматографияЖидкостно-твёрдофазная хроматографияЖидкостно-гелевая хроматографияСверхкритическая флюидная хроматография
По рабочему давлению Хроматография низкого давления (FPLC) Хроматография высокого давления (HPLC) Хроматография ультравысокого давления (UHPLC)
По механизму взаимодействия Аналитическая хроматография Полупрепаративная хроматография Препаративная хроматографияПромышленная хроматография
По способу ввода пробыЭлюентная хроматография (проявительная, редк. элютивная).Фронтальная хроматографияВытеснительная хроматография.
Предмет химической кинетики. Химическая кинетика, как основа для изучения скоростей и механизмов биохимических процессов. Реакции одностадийные(простые) и многостадийные (сложные), гомогенные и гетерогенные.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протеканияхимических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.[1]
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяетсяконцентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции
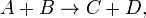 скорость можно выразить так:
скорость можно выразить так:
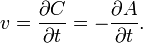
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Химическая кинетика – раздел физической химии, который изучает влияние различных факторов на скорости и механизмы химических реакций.
Под механизмом химической реакции понимают те промежуточные реакции, которые протекают при превращении исходных веществ в продукты реакции.
Основным понятием химической кинетики является понятие скорости химической реакции. В зависимости от системы, в которой протекает реакция, определение понятия «скорость реакции» несколько отличается.
Гомогенными химическими реакциями называются реакции, в которых реагирующие вещества находятся одной фазе. Это могут быть реакции между газообразными веществами или реакции в водных растворах. Для таких реакций средняя скорость (равна изменению концентрации любого из реагирующих веществ в единицу времени) .
Мгновенная или истинная скорость химической реакции равна
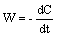 .
.
Знак минус в правой части говорит об уменьшении концентрации исходного вещества. Значит,скоростью гомогенной химической реакции называют производную концентрации исходного вещества по времени.
Гетерогенной реакциейназывается реакция, в которой реагирующие вещества находятся в разных фазах. К гетерогенным относятся реакции между веществами, находящимися в разных агрегатных состояниях.
Скорость гетерогенной химической реакции равна изменению количества любого исходного вещества в единицу времени на единицу площади поверхности раздела фаз: . 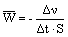
Кинетическим уравнением химической реакции называют математическую формулу, связывающую скорость реакции с концентрациями веществ. Это уравнение может быть установлено исключительно экспериментальным путём. В зависимости от механизма все химические реакции классифицируют на простые (элементарные) и сложные. Простыми называются реакции, протекающие в одну стадию за счёт одновременного столкновения молекул, записанных в левой части уравнения. В простой реакции могут участвовать одна, две или, что встречается крайне редко, три молекулы. Поэтому простые реакции классифицируют на мономолекулярные, бимолекулярные и тримолекулярныереакции. Так как с точки зрения теории вероятности одновременное столкновение четырёх и более молекул маловероятно, реакции более высокой, чем три, молекулярности не встречаются. Для простых реакций кинетические уравнения относительно просты. Например, для реакции H2+ I2 = 2 HI кинетическое уравнение имеет вид
 = k ∙ C(I2) ∙ C(H2).
= k ∙ C(I2) ∙ C(H2).
Сложные реакции протекают в несколько стадий, причём все стадии связаны между собой. Поэтому кинетические уравнения сложных реакций более громоздки, чем простых реакций.
Дата добавления: 2016-01-16; просмотров: 7599;
