Адсорбция на границе раздела жидкость-газ, жидкость-жидкость, твердое тело-газ, твердое тело-жидкость(раствор). Уравнение Гиббса.
Адсорбция (лат. ad — на, при; sorbeo — поглощаю) — увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твердая фаза-жидкость, конденсированная фаза - газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз[1]. Адсорбция является частным случаем сорбции, процесс, обратный абсорбции - десорбция[2].
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом (в случае газа и жидкости) или жидкостью (в случае газа) — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция. Если скорости адсорбции и десорбции равны, то говорят об установлении адсорбционного равновесия. В состоянии равновесия количество адсорбированных молекул остается постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и состав системы)[3].
ГИББСА-ДЮГЕМА УРАВНЕНИЕ, связывает изменения т-ры Т, давления р и хим. потенциалов 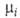 компонентов равновесных термодинамич. систем. В общем виде записывается в форме:
компонентов равновесных термодинамич. систем. В общем виде записывается в форме:
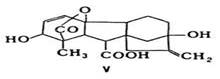
где 5 и К-энтропия и объем системы соотв., ni-число молей i-того компонента. Для процессов, происходящих при постоянных Т и р, Гиббса - Дюгема уравнение устанавливает связь между изменениями хим. потенциалов компонентов и Наиб. широко используется в термодинамике р-ров. Для р-ров неэлектролитов употребительны след. формы ур-ния:
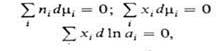
где 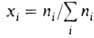 -молярная доля i-того компонента, аi-его активность, связанная с
-молярная доля i-того компонента, аi-его активность, связанная с 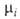 соотношением:
соотношением:
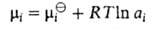
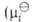 -хим. потенциал компонента в стандартном состоянии, R-газовая постоянная). Форма записи Гиббса - Дюгема уравнения для коэффициентов активности
-хим. потенциал компонента в стандартном состоянии, R-газовая постоянная). Форма записи Гиббса - Дюгема уравнения для коэффициентов активности 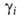 зависит от способа выражения концентрации (в молярных долях, молярности или моляльности). При выражении концентрации в молярных долях для р-ров неэлектролитов
зависит от способа выражения концентрации (в молярных долях, молярности или моляльности). При выражении концентрации в молярных долях для р-ров неэлектролитов 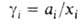 и Гиббса - Дюгема уравнение имеет вид: Для р-ров электролитов разработаны спец. формы
и Гиббса - Дюгема уравнение имеет вид: Для р-ров электролитов разработаны спец. формы 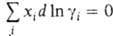 записи Гиббса - Дюгема уравнения.
записи Гиббса - Дюгема уравнения.
Гиббса - Дюгема уравнение позволяет определять зависимость от состава хим. потенциала, активности или коэф. активности одного из компонентов бинарного р-ра, если подобная зависимость известна для др. компонента (в случае многокомпонентных р-ров-для всех остальных компонентов). Гиббса - Дюгема уравнение применяют также для определения активности компонентов бинарного р-ра по данным о равновесном общем давлении пара над р-ром при данной Т.; с его помощью проверяют термодинамич. согласованность экспериментально определенных значений активности в-в (см. Активностьтермодинамическая).
Ур-ние предложено Дж. Гиббсом в 1876; его приложения впервые рассмотрены П. Дюгемом (Дюэмом) в 1886
Дата добавления: 2016-01-16; просмотров: 3616;
