Уравнение Аррениуса
В 1889 г. шведский ученый Сванте Аррениус на основании экспериментов вывел уравнение, которое названо его именем 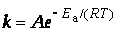 где k – константа скорости реакции; А – предэкспоненциальный множитель; е – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Значения Еа для химических реакций лежат в пределах 40 – 400 кДж/ моль.
где k – константа скорости реакции; А – предэкспоненциальный множитель; е – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Значения Еа для химических реакций лежат в пределах 40 – 400 кДж/ моль.
После логарифмирования уравнение имеет вид


Если представить графическую зависимость lnk = f(1/T), то она имеет вид (рис 17).
Здесь tgα = -Еа/R и Еа = - Rtgα. Отрезок, отсекаемый на оси ординат равен lnА.
Итак, константа скорости реакции (и скорость) возрастает с увеличением температуры по экспоненциальному закону. В соответствии с уравнением Аррениуса константа скорости реакции уменьшается с ростом энергии активации. Уравнение Аррениуса позволяет рассчитывать константы скорости (и скорости) при различных температурах.
Энергия активации
Аррениус предположил, что реагировать между собой могут только те молекулы, которые находятся в активной форме, образующиеся из обычных молекул. Такие молекулы были названы активными, а энергия, необходимая для перевода обычных молекул в активное состояние, энергией активации.
В самом деле, в ходе химической реакции разрушаются одни и возникают другие молекулы, происходит изменение химических связей, т.е. перераспределение электронной плотности. Если бы старые связи в ходе реакции сразу полностью разрушались, то на это потребовалось бы большое количество энергии, и реакция протекала крайне медленно. Как показали исследования, в ходе реакции система проходит через переходное состояние, через образование активированного комплекса. Например, ход реакции
АВ + DC = AD + BC В активированном комплексе старые связи еще не разорваны, но уже ослаблены, новые связи наметились, но еще не образовались. Время существования его не велико (10‾14 – 10‾11 с). При распаде комплекса образуются либо продукты реакции, либо исходные вещества. Для образования переходного комплекса необходима энергия. Система в переходном состоянии имеет более высокую энергию, чем в исходном и конечном состояниях. Энергия, необходимая для перехода вещества в состояние активированного комплекса, называется энергией активации. Образование активированного комплекса определяется энергией молекул. Молекула, энергия которой достаточна для образования активированного комплекса, называется активной. Доля таких молекул зависит от температуры. При высоких температурах доля активных молекул, энергия которых равна или выше энергии активации, велика и, соответственно, растет доля молекул способных к активным столкновениям с образованием активированного комплекса, т.е. реакции идут быстро. Чем выше энергия активации, тем меньше доля частиц, способных к активному взаимодействию. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические (рис.18). Высокая энергия активации (высокий энергетический барьер) является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя термодинамически возможны (ΔG < 0). Итак, энергия активации – это энергия, необходимая для перехода частиц в состояние активированного комплекса. Частицы, энергия которых равна или выше энергии активации, называются активными. С ростом температуры растет доля этих частиц и соответственно скорость реакции. С увеличением энергии активации уменьшается доля активных молекул и скорость реакции.
Дата добавления: 2016-01-16; просмотров: 1590;
