Электролиз. Числа переноса
Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах. Основными элементами такой системы являются: металлические или полупроводниковые электроды (проводники первого рода) и проводники второго рода (раствор электролита, его расплав или твердый электролит).
По направлению процесса взаимного превращения электрической и химической форм энергии различают две группы электрохимических систем: электролизеры и химические источники тока.
Электрохимическая система, работающая за счет внешнего источника тока, называется электролизером.В электролизерах при электролизеза счёт внешней электрической энергии в системе происходят электрохимические превращения. На границе электрод – раствор происходит передача электронов от электрода к ионам или от ионов к электроду.
При электролизе на катоде происходит процесс восстановления (электрод отдаёт электроны, полученные от внешнего источника тока) по реакции
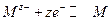 ,
,
а на аноде идет процесс окисления по реакции
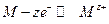 .
.
Освобождающиеся при окислении электроны поступают во внешнюю цепь.
Химические превращения при электролизе могут быть самыми различными, в зависимости от природы электролита и растворителя, а также от материала электрода и присутствия других веществ в растворе.
Количественными характеристиками процесса электролиза являются – масса полученных веществ, плотность тока, выход по току, напряжение электролиза и другие.
Масса вещества, разложившегося или образовавшегося при электролизе, прямо пропорциональна количеству пропущенного электричества этого:
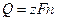 , (2.13)
, (2.13)
где 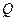 - количество электричества (Кл),
- количество электричества (Кл), 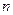 - количество вещества, участвующего в электродной реакции (моль),
- количество вещества, участвующего в электродной реакции (моль), 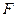 - число Фарадея (96500 Кл/моль-экв = 26,8 А ч/моль-экв),
- число Фарадея (96500 Кл/моль-экв = 26,8 А ч/моль-экв),  - число электронов, участвующих в электродной реакции.
- число электронов, участвующих в электродной реакции.
Из законов Фарадея следует, что при прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны их молярным массам. Отсюда
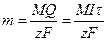 , (2.14)
, (2.14)
где - М – молярная масса вещества (г/моль), , 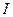 - сила тока (А),
- сила тока (А), 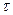 - продолжительность электролиза (с).
- продолжительность электролиза (с).
Число Фарадея является одной из основных постоянных современной физики. При пропускании через электролитическую ячейку одного фарадея электричества на аноде или на катоде в электрохимическую реакцию вступает моль/z количества вещества. Это следует из простого факта – заряд одного моля однозарядных ионов (N = 6,022 1023 ионов) составляет 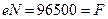 кулонов, где
кулонов, где 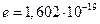 - заряд иона в кулонах. Следовательно, для окисления или восстановления одного моля однозарядных ионов необходим один фарадей электричества, для двух зарядных ионов – два фарадея и т. д.
- заряд иона в кулонах. Следовательно, для окисления или восстановления одного моля однозарядных ионов необходим один фарадей электричества, для двух зарядных ионов – два фарадея и т. д.
Плотность тока 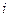 (А/м2) - это отношение силы тока к величине рабочей поверхности электрода. Плотность тока определяет скорость электродного процесса. Чем выше плотность тока, тем больше скорость процесса и производительность электролизера.
(А/м2) - это отношение силы тока к величине рабочей поверхности электрода. Плотность тока определяет скорость электродного процесса. Чем выше плотность тока, тем больше скорость процесса и производительность электролизера.
Законы Фарадея являются общими и точными законами электрохимии. Однако при электрохимических процессах часто наблюдаются отклонения от этих законов: масса mддействительно полученного или разложившегося продукта не соответствует теоретической mТ. Эти отклонения – кажущиеся и возникают за счёт одновременного протекания побочных электрохимических или химических процессов. Эффективность основного электрохимического процесса оценивается выходом по току: 
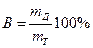 (2.15)
(2.15)
Для измерения количества прошедшего электричества используются электролизеры, в которых нет параллельных электрохимических и побочных химических реакций. Они называются кулонометрами.
По методам определения количества образующихся веществ кулонометры делятся на весовые, объемные, титрационные и др.
Например, действие серебряного кулонометра, представляющего собой электролизер
(-) Ag ½AgNO3 ½ Ag (+) ,
основано на взвешивании массы серебра, осевшей на катоде во время электролиза по реакции:
Ag+ + e = Ag0 .
При пропускании одного Фарадея электричества на катоде выделяется один моль-экв. cеребра, равный 107 г.
В объемных кулонометрах определяют изменение объемов газообразных веществ, являющихся продуктами электролиза.
В титрационных кулонометрах методом титрования определяют количества вещества, образовавшегося при электролизе.
Плотность тока 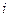 (А/м2) - это отношение силы тока к величине рабочей поверхности электрода. Плотность тока определяет скорость электродного процесса. Чем выше плотность тока, тем больше скорость процесса и производительность электролизера.
(А/м2) - это отношение силы тока к величине рабочей поверхности электрода. Плотность тока определяет скорость электродного процесса. Чем выше плотность тока, тем больше скорость процесса и производительность электролизера.
Процессы электролиза в принципе обратны процессам, протекающим на электродах при работе гальванического элемента. При электролизе сила тока, а, следовательно, и количество вещества, прореагировавшего на электродах, зависит от разности потенциалов (напряжения) на электродах. При повышении напряжения сила тока увеличивается, а при снижении, наоборот, - уменьшается. Для того, чтобы процесс электролиза протекал со значимым выходом, разность потенциалов, приложенная к электродам, должна быть не меньше некоторой определенной для данного процесса величиной.
Минимальная разность потенциалов, которую необходимо создать между электродами для того, чтобы на электродах пошел процесс электролиза с образованием электродных продуктов называется напряжением разложения. Напряжение разложения не может быть меньше, чем ЭДС гальванического элемента, в котором протекает суммарная реакция противоположного направления, чем при электролизе в электролизере.
В общем случае напряжение разложения складывается из разности электродных потенциалов анода и катода при плотности тока электролиза и падения напряжения в растворе электролита 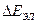 .
.
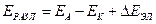 ,
,
где  - напряжение разложения,
- напряжение разложения, 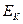 и
и 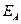 - потенциалы катода и анода.
- потенциалы катода и анода.
При работе электролизера происходит отклонение потенциалов электродов от равновесных значений (при отклонении потенциала электрода от равновесного через электрод протекает ток). Это явление называется поляризацией, а разность между потенциалом электрода и его равновесным значением называется перенапряжением на электродах. Перенапряжение принято считать положительной величиной. Поэтому анодное 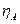 и катодное
и катодное  перенапряжения определяются следующими выражениями
перенапряжения определяются следующими выражениями
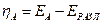 ;
; 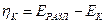 .
.
Термин перенапряжение применяется к отдельным электродным процессам и к данному процессу электролиза в целом. Перенапряжение электролиза равно сумме перенапряжений на электродах.
В водных растворах процесс электролиза осложняется возможной реакцией разложения воды: 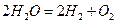 . На катоде могут протекать следующие реакции
. На катоде могут протекать следующие реакции
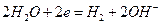 (нейтральная или щелочная среда),
(нейтральная или щелочная среда),
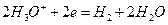 (кислая среда),
(кислая среда),
а на аноде
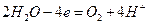 (кислая или нейтральная среда),
(кислая или нейтральная среда),
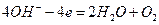 (щелочная среда).
(щелочная среда).
Потенциал восстановления ионов водорода в нейтральной среде равен -0,41 В, поэтому металлы с электродным потенциалом более положительным, чем эта величина (расположенные в ряду напряжений правее железа) восстанавливаются на катоде. Если электродный потенциал металла значительно отрицательнее, чем – 0,41 В, то металл не восстанавливается, а происходит восстановление воды и выделение водорода. Если электродный потенциал металла отрицательнее, но отличается от -0,41 В незначительно ( 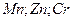 ), то возможно восстановления металла и воды. Восстановление таких металлов возможно потому, что для восстановления водорода требуется значительное перенапряжение. Например, перенапряжение водорода на ртутном электроде составляет - 0,57 В.
), то возможно восстановления металла и воды. Восстановление таких металлов возможно потому, что для восстановления водорода требуется значительное перенапряжение. Например, перенапряжение водорода на ртутном электроде составляет - 0,57 В.
Стандартный потенциал окисления воды равен 1,23 В. У простых анионов (  ) потенциал окисления меньше чем 1,23 В, поэтому на аноде происходит образование соответствующих простых веществ. Если в растворе находятся анионы, потенциал окисления которых выше, то на аноде идет окисление воды.
) потенциал окисления меньше чем 1,23 В, поэтому на аноде происходит образование соответствующих простых веществ. Если в растворе находятся анионы, потенциал окисления которых выше, то на аноде идет окисление воды.
Если анод изготовлен из металлов, электродные потенциалы которых ниже чем потенциал окисления анионов соли, то происходит окисление анода. Например, электролиз раствора  с использованием свинцового анода идет по следующей схеме:
с использованием свинцового анода идет по следующей схеме:
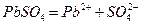
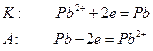 .
.
В этом случае новых веществ не образуется, а происходит перенос свинца с анода на катод.
Если в качестве анода использовать инертный электрод, например, графитовый, то на электродах будут протекать следующие реакции:
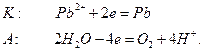
Скорости движения различных ионов в растворах электролитов отличаются друг от друга. Поэтому они при движении переносят разное количество электричества. Для оценки количества электричества, переносимого разными ионами введено понятие – число переноса. Числом переноса ионов называется доля количества электричества, переносимая данным видом ионов.
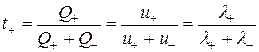 ; (2.16)
; (2.16)
 , (2.17)
, (2.17)
где t+ и t– – число переноса катиона и аниона.
К методам определения чисел переноса относят метод Гитторфа, основанный на определении изменения концентрации электролита в результате электролиза в катодном или анодном отделении электролизера и сопоставлении полученных результатов с данными материального баланса процесса электролиза.
Например, при пропускании через раствор соляной кислоты 1 фарадея (F = 96500 к) электричества в электролизере с платиновыми электродами (пространство между электродами разделено пористыми перегородками) будут протекать следующие электрохимические реакции:
на катоде 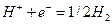 ;
;
на аноде 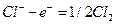 .
.
При этом через раствор от анода к катоду пройдет t+ моль катионов и от катода к аноду - t– моль анионов. Катионы перенесут t+ фарадеев электричества, а анионы - t– фарадеев. В сумме катионы и анионы перенесут t+ + t– = 1 фарадей электричества. В катодном отделении, в результате протекания реакции из раствора выделится 1 моль ионов водорода, а в анодном отделении из раствора выделится 1 моль анионов хлора. Материальный баланс катодного и анодного пространств тогда можно представить в следующем виде:
катодное пространство: 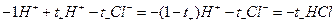 ;
;
анодное пространство: 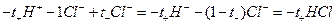 .
.
Из материального баланса следует, что при пропускании через раствор одного фарадея электричества в катодном пространстве содержание 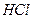 уменьшится на t– молей, а в анодном пространстве содержание
уменьшится на t– молей, а в анодном пространстве содержание 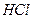 уменьшится на t+ молей.
уменьшится на t+ молей.
Если при пропускании через электролизер  фарадеев электричества
фарадеев электричества
(q – количество электричества в кулонах) содержание 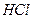 в катодном отделении уменьшилось на
в катодном отделении уменьшилось на 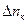 молей, а в анодном пространстве на
молей, а в анодном пространстве на 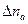 , то числа переноса можно определить из следующих соотношений:
, то числа переноса можно определить из следующих соотношений:
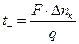 ;
;  . (2.18)
. (2.18)
Числа переноса можно также определить, используя метод движущейся границы. Этот метод основан на измерении скорости движения ионов, которая определяется по скорости перемещения границы между двумя растворами при прохождении тока. В вертикальной трубке имеются два слоя растворов электролитов СА и МА, образующих четкую границу, которая при прохождении тока перемещается со скоростью, равной скорости движения ионов.
Числа переноса находят следующим образом. При прохождении через систему одного фарадея электричества (1F = 96500 кулонов) через каждый 1 см2 сечения трубки должно пройти в направлении к катоду число моль-эквивалентов катионов, равное числу переноса tк. Если площадь поперечного сечения трубки равно s см2, а расстояние, пройденное границей за время пропускания q Кл, равно l см, то число переноса катиона равно
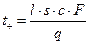 . (2.19)
. (2.19)
Так как q в Кл можно рассчитать, зная ток (в А) и время (в секундах) пропускания тока, то число переноса может быть вычислено по перемещению границы за время опыта.
Метод движущейся границы часто используется измерений чисел переноса вследствие его сравнительной простоты и точности получаемых результатов.
Дата добавления: 2016-01-09; просмотров: 2518;
