Влияние электролитов на электротермодинамический и электрокинетический потенциалы
По отношению к золю электролиты делятся на индифферентные и неиндиффе-рентные. В индифферентных электролитах отсутствуют ионы, которые могли бы адсорбироваться на поверхности коллоидных частиц. При введении в коллоидный раствор такого электролита наблюдается ионный обмен между противоионами ДЭС и ионами добавляемого электролита, сжатие диффузной атмосферы вокруг частиц. Например, при введении в коллоидный раствор {mAgI,nI-(n-x)K+}xK+
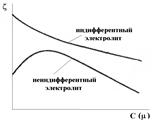 Рис.5. Влияние ионной силы электролитов на электрокинетический потенциал
Рис.5. Влияние ионной силы электролитов на электрокинетический потенциал
| электролита NaNO3, между ионами Na+ и противо-ионами ДЭС (K+) происходит ионный обмен. Взаимодействие этих ионов с потенциалопределяю-щими ионами (I-) примерно одинаково, поэтому диффузный слой будет содержать смесь ионов Na+ и K+. Увеличение концентрации противоионов приводит к увеличению ионной силы раствора, в результате чего уменьшается толщина ионной атмосферы и наблюдается сжатие диффузного слоя ДЭС. При этом часть противоионов из диффузного слоя переходит в адсорбционный слой и снижает величину дзета-потенциала. |
Влияние усиливается, если в электролите содержится многозарядный ион. Они более активно взаимодействуют с потенциалопределяющими ионами и вытесняют однозарядные ионы из адсорбционного и диффузного слоев в раствор, становясь на их место. При этом потенциал падает быстрее. При добавлении трех- и четы-
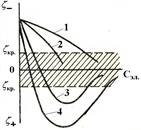 Рис.6. Зависимость z-потен-циала от концентрации электро-литов: 1–одно-, 2- двух-, 3-трех- и 4- четырехзарядные ионы
Рис.6. Зависимость z-потен-циала от концентрации электро-литов: 1–одно-, 2- двух-, 3-трех- и 4- четырехзарядные ионы
| рехзарядных ионов возможна перемена знака z-потен-циала. Это явление называется перезарядкой золя. Изменение знака дзета-потенциала объясняют сверх-эквивалентной адсорбцией многозарядных ионов. Например, при введении электролита Al(NO3)3 ионы Al3+ вначале электростатически притягиваются к отри-цательно заряженной поверхности и входят в диффуз-ный слой наравне с ионами калия. Из-за высокой адсорбируемости они проникают в адсорбционный слой и вытесняют ионы калия. Из-за большого заряда и небольшого (малого) размера их количество больше количества однозарядных ионов. |
В силу этих же причин, заряд их не полностью компенсируется общим зарядом потенциалопределяющих ионов. Некомпенсированные заряды поляризуют по-
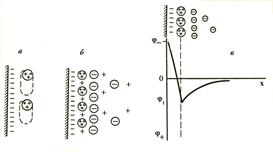 Рис.7. Схема сверхэквивалентной адсорбции тролитом. Они образуют диффузный слой.
Рис.7. Схема сверхэквивалентной адсорбции тролитом. Они образуют диффузный слой.
| верхность твердой фазы, придавая ей потенциал, противоположный по знаку исходному потенциалу. В рез-ультате перезарядки многозаряд-ными ионами ДЭС становится 3-слойным. При этом потенциалоп-ределяющими ионами становятся многозарядные ионы (Al3+). К ним из раствора притягиваются протии-воионы ( 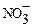 ), введенные элек- Строение мицеллы можно выразить ), введенные элек- Строение мицеллы можно выразить
|
следующим образом:
{mAgI,nI-,zAl3+[3(z-x)-n)] 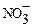 }3x
}3x 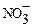
Влияние неиндифферентного электролита
Неиндифферентным называется электролит, содержащий ионы, способные достраивать кристаллическую решетку. Например, при введении в золь
{mAgI, nAg+(n-x) 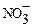 }х
}х 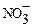 небольшого количества KI наблюдается увеличи-вается ионная сила раствора, приводящее к повышению z-потенциала. Избыточное количество KI будет реагировать с AgNO3 и образовывать дополнительное коли-чество дисперсных частиц AgI. На их поверхности уже будут адсорбироваться иодид-ионы и обуславливать отрицательный заряд поверхности. Потенциалоп-ределяющими ионами уже будут иодид-ионы, а противоионами – ионы К+: {mAgI, nI- (n-x) K+}х K+.В этом случае перезарядки изменяется знак не только дзета-потенциала, но и электротермо-динамического (j-) потенциала.
небольшого количества KI наблюдается увеличи-вается ионная сила раствора, приводящее к повышению z-потенциала. Избыточное количество KI будет реагировать с AgNO3 и образовывать дополнительное коли-чество дисперсных частиц AgI. На их поверхности уже будут адсорбироваться иодид-ионы и обуславливать отрицательный заряд поверхности. Потенциалоп-ределяющими ионами уже будут иодид-ионы, а противоионами – ионы К+: {mAgI, nI- (n-x) K+}х K+.В этом случае перезарядки изменяется знак не только дзета-потенциала, но и электротермо-динамического (j-) потенциала.
Коагуляция золей смесями электролитов (совместная коагуляция)
Коагуляция осложняется при применении смеси электролитов. При этом воз-можны 3 варианта действия электролитов. Аддитивность – суммарное коагули-рующее действие электролитов. Имеет место при отсутствии взаимодействия меж-ду ионами разных электролитов, т.е. когда электролиты содержат противоионы одинаковой валентности. Если один электролит присутствует в количестве 70% от его порога коагуляции, то для вызова коагуляции необходимо взять второй элек-тролит в количестве 30% от его порога коагуляции.
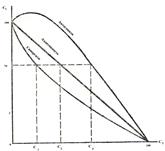
| Синергизм – явление взаимного усиления коагули-рующего действия электролитов. Обусловлено химическим взаимодействием ионов смеси с образованием ионов с большим зарядом, чем исходные ионы. В связи с этим, согласно правила Шульца-Гарди, новообразованные ионы обладают большей коагулирующей способностью. Поэтому, чтобы вызвать коагуляцию, второй электролит должен быть взят в количестве, меньше 30% от его порога коагуляции. |
Антогонизм ( пептизация) – явление взаимного ослабления коагулирующей способности электролитов. Обусловлено образованием новых ионов, обладающих меньшим зарядом по сравнению с зарядом исходных ионов. Поэтому, чтобы вызвать коагуляцию, их суммарная концентрация должна быть больше 100%.
Дата добавления: 2016-01-09; просмотров: 1336;
