Теории коагуляции электролитами
Существующие теории коагуляции пытались ответить на 3 вопроса:
− почему коагуляция наступает при определенной концентрации электролита-коагулятора?
− почему при этом основную роль играет концентрация иона, противоположного заряду гранулы?
− почему влияние заряда иона-коагулятора подчиняется правилу Шульце-Гарди?
Адсорбционная теория Фрейндлиха. Согласно этой теории, ионы-коагуляторы на поверхности частиц адсорбируются в соответствии с изотермой адсорбции: 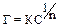 . Причем коагуляция наступает при постепенном, одинаковом понижении дзета-потенциала за счет адсорбции эквивалентного количества различных ионов. Вследствие нейтрализации уменьшается число зарядов потенциалопределяющих ионов, что приводит к снижению z-потенциала до критического значения.
. Причем коагуляция наступает при постепенном, одинаковом понижении дзета-потенциала за счет адсорбции эквивалентного количества различных ионов. Вследствие нейтрализации уменьшается число зарядов потенциалопределяющих ионов, что приводит к снижению z-потенциала до критического значения.
Ограниченность теории заключается в том, что на практике не всегда наблюдается эквивалентная адсорбция, изотермы адсорбции различных ионов различны, иногда коагуляция затрагивает только диффузный слой.
Электростатическая теория Мюллера. Согласно этой теории введение электролита не изменяет общий заряд в ДЭС, а вызывает лишь сжатие диффузного слоя (вытеснение противоионов в адсорбционный слой). Уменьшение толщины ионной атмосферы приводит к снижению z-потенциала, что уменьшает стабильность золя.
Данная теория не учитывает адсорбцию введенных ионов и их вхождение в ДЭС.
Обе теории справедливы, обе имеют место при коагуляции, но на разных стадиях. Из-за ограниченности не могут быть использованы для объяснения других видов коагуляции.
Теория ДЛФОразработана Дерягиным, Ландау, Фервей и Овербеком (1941 г.). В соответствии с первыми буквами фамилий авторов носит название ДЛФО. Она учитывает потенциальную энергию частиц и равновесие э/статических сил, действующих между ними. При сближении частиц между ними возникают э/статические силы притяжения и отталкивания. Состояние системы определяется их соотношением. Если силы отталкивания больше, то система устойчива. Преобладание энергии притяжения вызывает коагуляцию. Энергия притяжения обусловлена силами Ван-дер-Ваальса и изменяется обратно пропорционально квадрату расстояния между частицами: 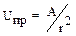 . Эти силы действуют только на очень малых расстояниях (1.10−10 – 1.10−11 м, т.е. 1/10 части размера коллоидных частиц). Поэтому коагуляция наблюдается только при сближении частиц на должном расстоянии. Такое сближение происходит в ходе теплового движения частиц и поэтому воздействия, увеличивающие скорость движения частиц и число столкновений (см. факторы вызывающие коагуляцию), способствуют коагуляции.
. Эти силы действуют только на очень малых расстояниях (1.10−10 – 1.10−11 м, т.е. 1/10 части размера коллоидных частиц). Поэтому коагуляция наблюдается только при сближении частиц на должном расстоянии. Такое сближение происходит в ходе теплового движения частиц и поэтому воздействия, увеличивающие скорость движения частиц и число столкновений (см. факторы вызывающие коагуляцию), способствуют коагуляции.
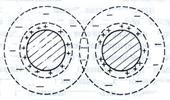 Рис.1. Перекрывание ионных атмосфер коллоидных частиц
Рис.1. Перекрывание ионных атмосфер коллоидных частиц
| По мере уменьшения расстояния между части-цами усиливаются силы электростатического отталкивания. Соприкосновению частиц препятствует и сольватная оболочка. Обычно силы электростатического отталкивания проявляются тогда, когда перекрываются диффузные слои (ионные сферы) одноименно заряженных частиц. Энергия отталкивания убывает с увеличением расстояния между ними. | |
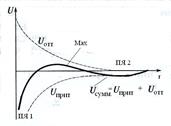 Рис.2. Потенциальная кривая коагуляции
Рис.2. Потенциальная кривая коагуляции
| Для определения состояния системы вычисляют суммарную энергию (строят потенциальную кривую коагуляции). В ней имеются несколько участков: глубокий первичный минимум (потенциальная яма 1) в области малых расстояний, неглубокий вторичный минимум (потенциальная яма 2) в области больших расстояний. Они указывают на значительное преобладание энергии притяжения, т.е. в них Uпр >> Uотт. | |
В области средних расстояний находится максимум. Если он располагается над осью абсцисс, то между частицами действуют силы отталкивания, т.е. система агрегативно устойчива. При этом Uотт >> Uпр. Чем выше максимум, тем устойчивее система.
Для начала коагуляции достаточна предварительная частичная нейтрализация заряда частиц до определенного значения и разрушение сольватной оболочки. Это достигается введением электролита или удалением стабилизирующего электролита. Минимальный заряд частиц, при котором начинается коагуляция, называется критическим z-потенциалом (~0,03 В). При критическом значении дзета-потенциала кинетическая энергия движения частиц достаточна для преодоления сил остаточного электростатического отталкивания (Uпр ~ Uотт) и слипания частиц в агрегаты.
Согласно теории ДЛФО при быстрой коагуляции электролитами различают два механизма: концентрационная коагуляция и адсорбционная (нейтрализационная) коагуляция.
При концентрационной коагуляции добавляемые индифферентные ионы не изменяют величину j-потенциала. Коагуляция происходит за счет сжатия диффузного слоя, т.е. вытеснения противоионов в адсорбционный слой либо за счет увеличения ионной силы раствора.
Адсорбционная коагуляция происходит в результате уменьшения j-потенциала. Этот вид коагуляции вызывают электролиты, ионы которых могут (способны) адсорбироваться на поверхности частиц и имеющие противоположный к грануле заряд. Они проникая в адсорбционный слой, нейтрализуют потенциалопределяющие ионы и снижают j-потенциал.
Если на поверхности микрокристаллов имеются свободные центры, то происходит достройка кристаллической решётки. Например, в случае золя {mAgI, nI- (n-x) K+}х K+добавление KI вызывает коагуляцию за счет адсорбции иодид-ионов. При этом сначала j- и z-потенциалы увеличиваются. После насыщения центров адсорбция прекращается. Дальнейшее увеличение концентрации KI приводит к снижению z-потенциала за счет сжатия диффузного слоя (вытеснения ионов калия в адсорбционный слой). При достижении определенной концентрации золь начинает коагулировать.
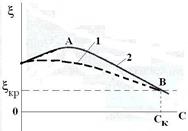 Рис.
Рис.
| Если на поверхности отсутствуют свободные центры, то адсорбция не наблюдается и j-потенциал не возрастает, но имеет место сжатие диффузного слоя. |
При добавлении AgNO3 неиндифферентными являются ионы серебра Ag+. Поскольку потенциалопределяющими ионами являются иодид- ионы, то добавление ионов серебра приводит к образованию труднорастворимого соединения AgI. В результате этого постепенно уменьшается число потенциалопределяющих, что приводит к снижению j- и z-потенциалов. При критическом значении z-потенциала золь коагулирует по адсорбционному механизму. Дальнейшее прибавление AgNO3 приводит к перезарядке и повышению положительного заряда гранулы за счет избирательной адсорбции ионов серебра с образованием нового ДЭС: {mAgI, nAg+ (n-x) NO3─}х NO3─. При дальнейшеь прибавлении AgNO3 золь коагулирует по концентрационному механизму под действием нитрат-ионов.
Дата добавления: 2016-01-09; просмотров: 1393;
