Коэффициент распределения
Распределение вещества между фазами в состоянии равновесия характеризуется коэффициентом распределения - отношением концентраций распределяемого вещества в органической и водной фазах при равновесии:
D = Cорг./Cвод.. = [a’оргg’вод.] / [(а’вод. g’орг] = K’p . (g’вод. / g’орг ) (48)
т. е. при данной температуре он пропорционален отношению концентрационных коэффициентов активности.
Если обе фазы представляют собой растворы, идеальные по отношению к растворителю, то
Da = Cорг./Cвод.. = Kp (49)
т. е. в этом случае коэффициент распределения постоянен. Это уравнение выражает закон распределения Бертло-Нернста. На практике закон Бертло-Нернста справедлив только в случае очень разбавленных растворов (10-3 – 10-5 М), когда молекулы распределяемого вещества не взаимодействуют ни с одним из растворителей и вещество ни в одной из фаз не образует многоядерных соединений.
Экспериментально определяемый коэффициент распределения какого-либо элемента представляет собой отношение аналитически определяемых концентраций в органической и водной фазах, независимо от того, в виде каких соединений элемент в них присутствует:
Da эксп.= åCорг. i / åCвод..j
i j
ЭКСТРАГЕНТЫ
Применяемые в промышленности редких металлов экстра-генты можно разделить на три больших класса: кислые, нейтральные и основные.
Металл, находящийся в водной фазе в форме катиона или анионного комплекса, экстрагируется в органическую фазу в виде электронейтрального недиссоциированного соединения с катионом или анионом экстрагента или в виде нейтральной молекулы соли, сольватированной молекулами экстрагента.
Кислые экстрагенты
Кислые экстрагенты являются жидкими катионообменниками, содержащими способный к замещению ион водорода. К ним относятся хелатирующие экстрагенты и кислоты: фосфорорганические, карбоксильные и сульфоновые.
Хелатирующие агенты действуют как слабые кислоты:
Mm+водн + mHXорг « MXm орг + mН+водн
Обычно MXm - устойчивое мономерное соединение, которое можно выделить в твердом виде, практически нерастворимое в воде и хорошо растворимое в органических растворителях.
Хелатирующие агенты содержат также донорную группу, способную к образованию с экстрагируемым металлом бидентатного хелата. При взаимодействии иона экстрагируемого металла с хелатирующим агентом кислотный остаток экстрагента нейтрализует заряд иона металла, а оставшиеся свободными координационные места заполняются или теми же молекулами экстрагента с образованием хелата, или молекулами воды (если еще остаются свободные координационные места).
При низкой концентрации хелата органические растворы близки к идеальным, и такие системы хорошо подчиняются закону действующих масс.
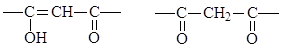 Примерами наиболее типичных хелатирующих экстрагентов являются:
Примерами наиболее типичных хелатирующих экстрагентов являются:
b -дикетоны:
енольная форма, кето-форма
способная к экстракции
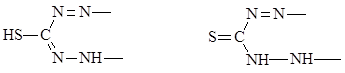 дитизон:
дитизон:
енольная форма кето-форма
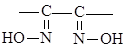
монооксимы:
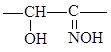
диоксимы:
Широко используемым в экстракции соединением является b-дикетон - теноилтрифторацетон (ТТА). Его енольная форма:
 |
ТТА удобен тем, что его легко получить в чистом виде; высокая кислотность енольной формы позволяет работать с довольно кислыми растворами.
Органические кислоты (фосфорорганические, карбоксильные, сульфоновые) - обычно слабые кислоты, малорастворимые в воде. Экстрагируемые комплексы вида МХ,п дополнительно сольватированы в органической фазе, причем количество молекул экстрагента может быть различным.
Широкое распространение в экстракции получили фосфорорганические кислоты:
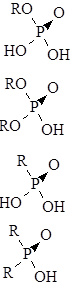
моноалкилфосфорные общего вида:
диалкилфосфорные:
моноалкилфосфоновые:
диалкилфосфоновые:
и т. д.
В органическом растворе фосфорорганические кислоты ассоциированы посредством водородных связей. Моноосновные кислоты образуют димеры, а двухосновные - полимеры различного состава.
При взаимодействии димера моноосновной кислоты с экстрагируемым ионом металла в реакцию вступает одна молекула димера, причем один ион водорода остается незамещенным.
Общее число молекул экстрагента в комплексе определяется зарядом иона:
Mm+водн + m(HX)2 орг « M(Х.НX)m орг + mН+водн
При этом образуется хелатная структура вида
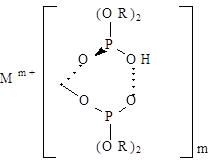
Кроме того, полученный комплекс сольватируется молекулами экстрагента до заполнения координационного числа экстрагируемого иона:
Mm+ + n/2 (HX)2 орг « MXm(n-m)НX орг + mН+водн
В зависимости от состава водной фазы в органическую фазу экстрагируются комплексы либо только с органическими анионами, либо смешанные - с неорганическими и органическими.
При высокой кислотности водного раствора, когда диссоциация органической кислоты подавлена, экстракция происходит по сольватному механизму с образованием координационной связи между атомом металла и полярным кислородным атомом экстрагента.
Одним из наиболее известных экстрагентов этого класса является ди-2-этилгексилфосфорная кислота (Д2ЭГФК):

Свойства Д2ЭГФК: молекулярная масса - 322, tкип = 292°C, tвсп = 475°С, плотность 0,975 г/см3, вязкость при 25° С - 4,22 спз, nD20 = 1,4443.
Д2ЭГФК - сильный экстрагент, что в значительной степени затрудняет реэкстракцию извлекаемых соединений. При экстракции в Д2ЭГФК экстрагируемость элементов улучшается с увеличением заряда иона, а внутри каждой группы ухудшается с увеличением ионного радиуса.
Дата добавления: 2019-04-03; просмотров: 1200;
