Основные экстрагенты
При экстракции в соединения этого класса происходит взаимодействие анионов, содержащих металл, с солями органических соединений или с катионами этих солей (катионом алкиламмония, алкиларсония или алкилфосфония).
Поскольку металл экстрагируется в составе сложных металлсодержащих комплексов, большое влияние на экстрагируемость и селективность оказывает состав водной фазы.
Из экстрагентов этого класса наибольшее значение имеют длинноцепочечные амины. Экстрагентом в данном случае является соль амина. Возможны два описания механизма экстракции солями аминов: реакцию экстракции можно представить как ионообмен или как реакцию присоединения. При ионообмене соль амина обменивает свой анион на анион, содержащий металл из водной фазы. Реакция аналогична реакциям с анионо-обменными смолами. Ее можно записать в виде:
R3Nорг + Н+ + А- « R3NH+ + А-орг;
R3NH+ + B- « R3NН+B-орг + А-;
Образовавшееся соединение может дополнительно сольватироваться солью органического основания.
С другой точки зрения, соли аминов, как и фосфорорганические соединения, можно рассматривать как экстрагенты электронодонорного типа. В солях аминов и четвертичных аммониевых оснований роль нуклеоофильного (электронодонорного) центра играет анион, входящий в состав этих солей. Способность соли металла экстрагироваться одноименной солью амина определяется способностью основного аниона - лиганда системы образовывать недиссоциированные комплексы типа МАm с катионом извлекаемого металла и, кроме того, способностью этого аниона, входящего в состав соли амина, образовывать координационную связь с атомом металла, увеличивая число присоединенных к металлу анионов-лигандов до возникновения в экстрагирующемся соединении структуры комплексного аниона [МАm+n]n-. В соли амина вида R'R''R''' NHA нуклеофильность аниона А- зависит, с одной стороны, от влияния заместителей, присоединенных к атому азота, а с другой - от природы самого аниона А-, определяемой тем, какая кислота присутствует в водной фазе, равновесной с амином.
Экстракционная способность аминов увеличивается в ряду: первичные < вторичные < третичные < четвертичные.
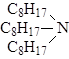 В технологии редких элементов из аминов чаще всего используется три-н-октиламин (ТОА):
В технологии редких элементов из аминов чаще всего используется три-н-октиламин (ТОА):
Молекулярная масса ТОА 353, tкип = 340°С, tвсп = 145°С, плотность 0,82 г/см3, вязкость 6,02 спз, nD20 =1,4490.
В органической фазе возможна ассоциация солей алкилами-нов в результате образования водородных связей и дипольного взаимодействия. Полимеризация солей аминов зависит от их концентрации, свойств разбавителя, длины алкильных цепей амина, температуры, а также природы соли: бисульфат и перхлорат ассоциированы в большей степени, чем нитрат и хлорид. Бисульфат триоктиламина агрегирован больше, чем сульфат. Соли три-н-октиламина в бензоле в большом интервале концентраций димеризованы.
При низких концентрациях Н2SO4 образуется сульфат амина, при более высоких - бисульфат.
При очень низких кислотностях возможна также экстракция амином по сольватному механизму.
В некоторых случаях при экстракции аминами наблюдается образование третьей фазы из-за ограниченной растворимости соли амина в разбавителе. Образование третьей фазы наиболее характерно для систем аминосульфат - алифатический углеводород. Для предотвращения образования третьей фазы к разбавителю добавляют небольшое количество длинноцепочечного спирта. Молекулы спирта взаимодействуют с ионной парой соли амина и изменяют ее диэлектрические свойства.
Дата добавления: 2019-04-03; просмотров: 907;
