Переведення наважки у розчин
Найважливішим етапом аналізу являється вибір розчинника для розчинення досліджуваної речовини. Деякі речовини розчинні у воді, але частіше для розчинення необхідно використовувати інші розчинники, їх слід вибирати таким чином, щоб розчинення було повиним. Під час вибору розчинника необхідно враховувати і хімічний склад досліджуваного матеріалу. Найбільш часто для розчинення використовують кислоти: хлоридну, сульфатну, нітратну, хлорну чи їхні суміші; іноді застосовують розчини гідроксидів лужних металів.
Розчинення наважки звичайно проводять у хімічних склянках вмісткістю 200-500 мл. Необхідно слідкувати, щоб не загубилася частина речовини під час розчинення за рахунок розбризкування розчину, якщо реакція розчинення перебігає бурно, чи якщо під час розчинення виділяються пухирці газів, які можуть потягнути за собою частину розчину. Тому стакан обов’язково закривають годинниковим склом таким чином, щоб його опукла частина була звернена усередину склянки. Розчинник додають поступово, невеликими порціями, обережно приливають його по внутрішній стінці склянки.
Іноді для прискорення розчинення слід нагрівати вміст склянки. Для нагрівання застосовують водневу або піщану баню. Нагрівання повинно бути поступовим та рівномірним. Ряд речовин неможливо перевести у розчинний стан за допомогою рідких реагентів. У цих випадках застосовують сплавлення за допомогою плавней. Сплавлення має ряд недоліків і в першу чергу той, що досліджуваний розчин, який одержують в результаті сплавлення, більш забруднений сторонніми речовинами, тому що плавні беруть у великих кількостях.
Осадження
У гравіметрії застосовують різні осаджувачі (неорганічні та органічні). Осадження проводять у хімічних стаканах вмісткістю 200-400 мл, як правило, з гарячих розбавлених розчинів шляхом додавання розчину реагента-осаджувача під час безперервного перемішування розчину.
Перед усім розраховують необхідний об’єм розчину-осаджувача з урахуванням його невеликого надлишку. Розраховують об’єм розчинника виходячи з наважки зразку та приблизного вмісту в ньому визначаємого компоненту. Розраховану кількість розчину осаджувача поміщають у бюретку. Досліджуваний розчин розбавляють до необхідного об’єму, додають допоміжні реагенти та нагрівають. Ставлять склянку під бюретку та краплинами додають розчин-осаджувач за безперервному перемішуванні. Перевіряють повноту осадження.
Відфільтровування та промивання осадів
Кристалічні осади відфільровують після їх настоювання протягом декількох часів. Аморфні осади відфільтровують через 5-10 хвилин після осадження. Відділяти осад можна за допомогою спеціальних фільтруючих тиглів (фарфорових та скляних) та фільтрувального паперу. Фільтруючі тиглі розрізняються за номерами в залежності від розмірів пор дна та можуть бути використані для відфільтровування осадів різної дисперсності. У скляних тиглях дно представляє собою пористу скляну пластину; вони теж розрізняються за номерами в залежності від розмірів пор фільтруючої пластини.
Перед роботою тиглі ретельно промивають кислотами, водопроводною водою та дистильованою водою. Промивання тиглей та відфільровування через них осадів проводять з відсмоктуванням рідини під вакуумом.
Частіше у гравіметрії застосовують спеціальні паперові фільтри. Фільтри для гравіметрії називаються беззольними. Беззольні фільтри бувають різного ступеня пористості, який позначають спеціальною стрічкою. Вибір фільтра визначається характером осаду. Фільтри бувають різних розмірів. Розмір фільтру вибирають не за об’ємом рідини, яку необхідно відфільтрувати, а за об’ємом осаду ¾ він повинен займати не більше половини складеного конусом фільтра.
Доведення тиглів до постійної маси. Висушування та прокалювання осадів
Чистий тигель висушують чи прокалюють протягом години у тих самих температурних умовах, в яких будуть висушувати чи прокалювати осад. Потім тигель за допомогою тигельних щипців переносять в ексікатор ¾ спеціальний сосуд, який використовують для захисту предметів від поглинання вологи з повітря. У нижній частині ексикатору знаходиться осушуюча речовина. Тигель охолоджують в ексікаторі до кімнатної температури і зважують. Операцію проводять до тих пір доки два зважування будуть відрізнятись один від одного не більше чим на 0,2 мг.
У тигель поміщають фільтр з осадом, ставять на фарфоровий трикутник і нагрівають його на маленькому полум’ї газового пальника. Після прокалювання тигель охолоджують у ексікаторі до температури вагової кімнати, зважують та повторюють прокалювання та зважування до досягнення постійної маси тигля з осадом.
Розрахунки
Визначення вмісту в технічному продукті
Приклад
Визначити вміст BaCl2×2H2O у зразку технічного барію. Наважка 0,5965 г. Маса барій сульфату дорівнює 0,4646 г.
Розв’язання
Для визначення барію використовують реакцію його осадження за допомогою сульфатної кислоти:
BaCl2×2H2O+Н2SO4=BaSO4+2H2O+2HCl.
М(BaCl2×2H2O)=244,3 г/моль, М(BaSO4)=233,4 г/моль.
233,4 г BaSO4 одержуються з 244,3 г BaCl2×2H2O
0,4646 г ¾ х г
х= 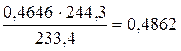 г.
г.
W(BaCl2×2H2O),%= 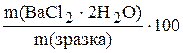 ;
;
W(BaCl2×2H2O),%= 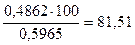 .
.
Відповідь: W(BaCl2×2H2O)=81,51%.
Визначення вмісту барію у зразку
m(BaCl2×2H2O)=0,4862 г
m(BaSO4)=0,4646 г
М(BaSO4)=233,4 г/моль, M(Ba)=137,4 г/моль.
У 233,4 г BaSO4 міститься 137,4 г Ba
У 0,4646 г BaSO4 ¾ х гBa
х= 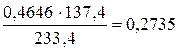 г.
г.
W(Ba),%= 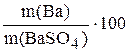 ; W(Ba),%=
; W(Ba),%= 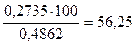 .
.
Відповідь: W(Ba)=56,25%.
Основні вимоги до осаджуваної та вагової форм осаду
Вимоги до осаджуваної форми
· Осад повинен бути практично нерозчинним. Визначаємий компонент повинен виділятись в осад кількісно, при цьому його концентрація в розчині після осадження не повинна перевищувати 10-6 М. Осадження вважається кількісним, коли кількість осаджуваної речовини, що залишилась, лежить за межами точності зважування на аналітичних терезах (0,0002 г).
· Осад повинен виділятись у формі, яка є зручною для її відділення від розчину і промивання, та по можливості бути крупнокристалічним, якщо він кристалічний, чи гарно прокоагуліровавшим, якщо від аморфний. Важно, щоб від був однорідним за дисперсністю.
· Осад повинен бути чистим, тобто не містити домішок.
Вимоги до гравіметричної форми
· Гравіметрична форма повинна бути стехіометричною сполукою відомого складу.
· Вона повинна бути стійкою.
· Бажано, щоб значення гравіметричного фактора F було найменшим (для зниження відносної похибки результату визначення необхідного компонента).
Оптимальні умови одержання кристалічних і аморфних осадів в гравіметрії
Результат гравіметричного визначення залежить від стуктури осаду та розміру його частиць, які в свою чергу залежать від природи сполуки і умов формування осаду.
Умови одержання кристалічних осадів
· Необхідно зменшити відносне пересищення.
· Осаждення повинно бути повільним.
· Необхідно залишати осад під маточним розчином для старіння.
Умови одержання аморфних осадів
· Необхідно вести осадження з гарячого розчину при перемішуванні у присутності електроліту у кількості, достатній для коагуляції осаду.
· Залишати осад не більш, ніж на одну-дві години у гарячому маточному розчині. При цьому видаляється слабо зв’язана води і в результаті осад стає більш плотним.
Застосування гравіметричних методів
Визначення неорганічних сполук
Гравіметрично можна визначати більшість неорганічних катіонів, аніонів, нейтральних сполук типу O2. H2O, CO2, SO2. Для осадження застосовують неорганічні та органічні реагенти. Останні, як правило, більш селективні.
Таблиця 13
Неорганічні осаджувачі
| Осаджувач | Речовина, яку визначають | Осаджувана форма | Гравіметрична форма |
| NH3 (водн.) | Al(III), Fe(III), Sc(III), Sn(IV) | MnOm×xH2O | MnOm |
| H2SO4 | Ba(II), Pb(II), Sr(II) | MSO4 | MSO4 |
| HCl | Ag(I) | AgCl | AgCl |
| HNO3 | Sn(IV) | SnO2×xH2O | SnO2 |
| (NH4)2C2O4 | Ca(II), Th(IV) | CaC2O4×H2O, Th(C2O4)×6H2O | CaO, ThO |
| (NH4)2HPO4 | Mg(II), Zn(II), Mn(II), Cd(II) | MNH4PO4×xH2O | M2P2O7 |
| Bi(III) | BiPO4 | BiPO4 | |
| BaCl2 | SO42- | BaSO4 | BaSO4 |
| MgCl2 (NH3, NH4Cl) | PO43- | MgNH4PO4×6H2O | Mg2P2O7 |
Осади сполук з органічними лігандами легко фільтруються та очищуються під час промивання. Ці осади негігроскопічні. Найбільш ефективні хелатоутворюючі реагенти. Якщо використовувати маскування та зміну рН, можна домогтися високої селективності. Йонні асоціати, які одержують під час взаємодії об’ємних органічних катіонів та аніонів із неорганічними йонами, як правило, малорозчинні, що використовують у аналізі, наприклад, для визначення сульфату у вигляді бензидин сульфату, нітрату у вигляді нітрон нітрату.
Визначення органічних сполук
Гравіметрія має обмежене застосування в аналітичній хімії органічних речовин. Однак, описаний ряд реакцій на деякі функціональні групи (карбонільну, ароматичну, азо-, сульфо-, метоксі-, ароматична карбонільна). Іноді використовують різні попередні операції. Наприклад, саліцилову кислоту визначають за реакцією з йодом. Жовтий осад тетрайодфениленхінону відфільтровують, висушують та зважують. Цим методом можна визначати ацетилсалицилову кислоту (аспірин) після її гідролізу до салицилової кислоти.
Нікотин в отрутохімікатах визначають осадженням з кремнієвовольфрамовою кислотою. Органічні сполуки, що місять фосфатну групу, можна визначити осадженням у вигляді їх солей з барій(ІІ)-іонами.
Література: [3] с. 5-28; [8] с. 248-270
ЛІТЕРАТУРА
Основна література
1. Хомченко І.Г. Загальна хімія: Підручник: Пер. з рос.-К.: Вища шк., 1993.-424 с.; ил.
2. Ахметов Н.С. Общая и неорганическая химия: Учеб. для химико-технол. вузов.-2-е изд., перераб. и доп.-М.: Высш. шк., 1988.-640 с.; ил.
3. Основы аналитической химии. В 2 кн. Кн.1. Общие вопросы. Методы разделения. Кн.2. Методы химического анализа./Под ред. Ю.А.Золотова. - М.: Высшая школа, 2000.
4. Харитонов Ю.Я. Аналитическая химия (аналитика). В 2 кн.- М.: Высшая школа, 2001.
Методичні матеріали до дисципліни
12. Мурликіна Н.В., Аксьонова О.Ф. Крівіч В.В. Хімія та методи дослідження сировини та матеріалів. Методичні вказівки для самостійної підготовки та виконання лабораторних робіт студентами товарознавчого факультету, 2002 р.
13. Добровольська О.В. Смірнова І.С. Лабораторний практикум з аналітичної хімії : Навч. посібник. Частина 1. Якісний аналіз. / Харківський державний університет харчування та торгівлі. - Харків, 2004. с. 96, табл. 10.
13. Смірнова І.С. Аксьонова О.Ф. Методичні вказівки до самостійної роботи та контрольні завдання з курсу «Хімія та методи дослідження сировини та матеріалів» Розділ «Загальні основи аналітичної хімії» для студентів І курсу товарознавчого факультету, 2004 р.
Розділ 2. ФІЗИЧНА ХІМІЯ СИРОВИНИ ТА ТОВАРІВ
Лекція №1
Основні закони термодинаміки. Термохімія
План лекції
1. Основні поняття термодинаміки. Предмет і зміст фізичної хімії.
2. Перший закон термодинаміки.
3. Другий закон термодинаміки. Поняття про ентропію.
4. Теплові ефекти термохімічних реакцій. Закон Гесса.
5. Теплоємність речовин. Калориметрія. Визначення калорійності харчових продуктів.
Рекомендована література: [1] С.175-217, [2] С.7-14, 15-18, [3] С.5-22, [4] С.111-117.
1.1 Основні поняття термодинаміки
Термодинаміка являє собою науку, яка вивчає переходи енергії із однієї форми в іншу або від однієї системи до іншої, а також енергетичні ефекти, що супроводжують фізико-хімічні процеси, можливість і напрямок перебігу цих процесів. Хімічна термодинаміка у свою чергу вивчає взаємне перетворення різних видів енергії у формі теплоти або роботи під час перебігу хімічних реакцій.
Термодинамічною системою називають частину простору, фактично або умовно виділену із навколишнього середовища. Якщо між системою і середовищем здійснюється перебіг процесів теплообміну або перенос маси, то така система називається відкритою. Якщо ж взаємодія між середовищем і системою відсутня, то така система називається ізольованою. Фізичні величини, що характеризують стан системи, називають параметрами. У термодинаміці застосовують три основних параметри: об’єм – V, тиск – Р, температура – Т. Будь-яка зміна параметрів системи називається термодинамічним процесом. Процес, що відбувається за сталої температури називають ізотермічним, за сталого об'єму – ізохорним, за сталого тиску – ізобарним. У термодинаміці користуються також функціями від цих параметрів, такими як внутрішня енергія системи, ентальпія, ентропія тощо. Внутрішня енергія системи U – являє собою суму кінетичної енергії руху усіх часточок системи (електронів, атомів, тощо) та потенціальної енергії їх взаємодії (ядерну, хімічну тощо), за винятком енергії самої системи в цілому. Внутрішня енергія є функцією стану, тобто її зміна визначається тільки вихідним та кінцевим станами системи: DU = U2 – U1. Ще однією функцією стану є ентальпія Н, яка дорівнюєсумі U + РV.У термодинаміці користуються поняттями “теплота” і “робота”. Теплота Q і робота А – це форми передачі енергії від однієї системи до іншої. Теплотою називають форму передачі енергії, що здійснюється внаслідок хаотичного руху молекул. Під час виконання роботи енергія передається шляхом упорядкованого руху молекул під дією зовнішньої сили.
1.2 Перший закон термодинаміки
Перший закон термодинаміки є окремим випадком закону збереження енергії. Можна надати кілька його рівноцінних формулювань:
· Енергія не зникає без сліду і не виникає з нічого, а тільки переходить із одного виду в інший або від однієї системи до іншої у строго еквівалентній кількості.
· В ізольованій системі загальний запас внутрішньої енергії є величина стала.
· Вічний двигун І роду, тобто періодично діюча машина, що виконує роботу, не витрачаючи при цьому енергії, неможливий.
Перший закон термодинаміки можна виразити аналітично у вигляді рівняння:
Q = DU + А.(1.1)
Тобто теплота – Q, що надається системі, витрачається на збільшення її внутрішньої енергії – DU та роботу – А, що виконується цією системою.
1.3 Другий закон термодинаміки
Другий закон термодинаміки дає можливість зробити висновок про можливість та напрямок перебігу фізико-хімічних процесів. Існує декілька формулювань ІІ закону термодинаміки:
· Теплота не може самочинно переходити від холодного тіла до більш гарячого (постулат Клаузіуса).
· Різні види енергії прагнуть перетворитися на теплоту, яка в свою чергу розсіюється, тобто рівномірно розподіляється у просторі (постулат Томсона).
· Будь-яка форма енергії може повністю перетворитися на теплоту, але теплота перетворюється в інші форми енергії лише частково (постулат Планка).
· Вічний двигун ІІ роду, тобто машина, що повністю перетворює всю одержану теплоту на роботу, неможливий (постулат Освальда).
Ентропія. Усі самочинні фізико-хімічні процеси поділяються на оборотні і необоротні. Якщо після перебігу процесу система і навколишнє середовище повертаються в первісний стан, то такий процес називається оборотним.
Відношення теплоти процесу до температури, за якою він відбувається, називається приведеною теплотою. Це функція, що характеризує стан системи, яка пізніше дістала назву ентропія – S = 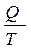 . Для будь-яких самочинних процесів:
. Для будь-яких самочинних процесів:
S2 – S1 = DS ³.0 (1.2)
Рівняння (1.2) є аналітичним виразом ІІ закону термодинаміки. Тобто ентропія ізольованої системи під час перебігу в ній оборотних процесах не змінюється (S2=S1), а під час перебігу необоротних процесів – збільшується (S2>S1), доки система не перейде у рівноважний стан, де ентропія сягає максимуму.
Отже, в ізольованих системах можливість перебігу процесів визначається за зміною ентропії: процес відбувається самочинно, якщо ентропія системі при цьому збільшується – DS>0. Відомо, що молекули, атоми, іони перебувають у безперервному хаотичному русі, безперервно змінюючи свій стан – змішуються, розсіюються. Будь-яка термодинамічна система прагне перейти у більш невпорядкований стан. Кількісною мірою невпорядкованості системи є ентропія. Чим більша ентропія, тим вищим є ступінь невпорядкованості даної системи. Згідно з постулатом Планка ентропія ідеального кристала простої речовини за температури 0 К наближається до нуля. У разі переходу речовини з твердого стану у рідкий, і тим більше у газоподібний стан або плазму значення її ентропії стрімко зростає.
1.4 Термохімія
Термохімія – розділ хімічної термодинаміки, в якому вивчають теплові ефекти хімічних реакцій. Тепловим ефектом хімічної реакції називають кількість теплоти, що виділяється або поглинається під час перебігу хімічної реакції за умов сталого тиску або об’єму. Тепловий ефект реакції, що перебігає в системі за сталого об'єму і температури, дорівнює зміні внутрішньої енергії цієї системи:
QV = U2 – U1 = DU.(1.3)
У природі і техніці більшість хімічних реакцій перебігають за сталого тиску, який дорівнює зовнішньому атмосферному тиску. Тепловий ефект реакції, у цьому випадку дорівнює зміні ентальпії системи під час перебігу цієї реакції:
QР = Н2 –Н1 = DН.(1.4)
Визначивши тепловий ефект реакції, що відбувається за сталого тиску – DН, можна розрахувати його значення за ізохорних умов – DU:
DU = DH – DnRT,(1.5)
де Dn – різниця між числом молів газоподібних продуктів реакції і реагентів.
Хімічні реакції, що перебігають з виділенням теплоти називаються екзотермічними, а реакції, що супроводжуються поглинанням теплоти з навколишнього середовища – ендотермічними. Ендотермічні реакції мають додатний знак теплового ефекту (DH>0 або DU>0), а екзотермічні – від’ємний знак (DH < 0 або DU < 0 ). Під час написання термохімічних рівнянь реакцій обов'язково вказується тепловий ефект реакції та агрегатний стан усіх реагентів.
Основний закон термохімії був встановлений Г.І.Гессом: "Тепловий ефект хімічної реакції не залежить від шляху перебігу реакції, а визначається лише станом регентів і продуктів реакції". Існує два висновки з закону Гесса.
1).Тепловий ефект реакції дорівнює різниці між сумами теплот утворення продуктів реакції і теплот утворення реагентів з урахуванням відповідних стехіометричних коефіцієнтів.
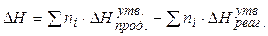 (1.6)
(1.6)
Теплота утворення – це тепловий ефект реакції утворення 1 моля сполуки з простих речовин за стандартних умов. Стандартним умовам відповідає температура – 298 К і загальний тиск – 1 атм. Теплоти утворення сполук наводяться у довідниках фізико-хімічних величин.
2).Тепловий ефект реакції дорівнює різниці між сумами теплот згоряння реагентів і теплот згоряння продуктів реакції з урахуванням відповідних стехіометричних коефіцієнтів.
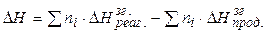 (1.7)
(1.7)
Теплота згоряння – це тепловий ефект реакції взаємодії 1 моля сполуки з киснем за умов, що при згорянні речовин, які містять Карбон, Гідроген, Сульфур і Нітроген, утворюються відповідно СО2, Н2О, SO2, N2.
1.5 Теплоємність речовин
Закон Кірхгофа дозволяє визначати теплові ефекти хімічних реакцій за будь-якої температури, якщо, ви знаєте тепловий ефект цієї реакції за однією певною температурою. Рівняння Кірхгофа в інтегральній формі має такий вигляд:
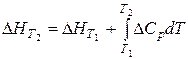 , (1.8)
, (1.8)
де DС – зміна теплоємності системи, яка має місце внаслідок перебігу цієї реакції. Молярна теплоємність речовини Ср визначається за кількістю теплоти, яку необхідно надати 1 молю речовини, щоб нагріти її на один градус.
Як правило, температуру Т1 беруть рівною 298 К, оскільки у цьому випадку 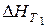 легко розрахувати за законом Гесса. У вузькому інтервалі температур нехтують залежністю теплоємності від температури, і тоді:
легко розрахувати за законом Гесса. У вузькому інтервалі температур нехтують залежністю теплоємності від температури, і тоді:
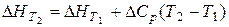 (1.9)
(1.9)
Калориметрія
Калориметрія являє собою сукупність методів визначення калорійності харчових продуктів. Калорійність харчових продуктів, як правило, виражають у кілокалоріях: 1 ккал = 4,184 кДж. Дослідним шляхом калорійність харчових продуктів визначають у спеціальних приладах – калориметрах, в яких спалюють зразки харчових продуктів певної маси. Чим більше зразок містить жирів, білків та вуглеводів, тим більше теплоти виділяється під час його згоряння і тим більша його калорійність. В організмі людини окиснення поживних речовин проходить поступово через ряд проміжних стадій, однак відповідно закону Гесса, загальна кількість теплоти, що виділяється при цьому буде такою ж, як і під час спалювання цих речовин у калориметрі. У табл. 1.1 наведені середні теплоти згоряння вуглеводів, жирів та білків.
Таблиця 1.1 – Теплота згоряння основних видів поживних речовин
| Речовина | Теплота згоряння 1 г продукту, ккал | |
| у калориметрі | в організмі людини | |
| Вуглеводи | 4,1 | 4,1 |
| Жири | 9,3 | 9,3 |
| Білки | 5,7 | 4,3 |
На лекції наводяться приклади розрахунків теплових ефектів хімічних реакцій і калорійності зразків харчових продуктів, з відомим вмістом поживних речовин.
Лекція №2
Термодинаміка хімічної рівноваги
План лекції
1. Термодинамічні потенціали. Зміна вільної енергії системи в оборотних процесах.
2. Хімічна рівновага. Константа рівноваги. Зміщення хімічної рівноваги.
3. Хімічна спорідненість. Рівняння ізотерми хімічної реакції.
Рекомендована література: [1] С.217-237, 254-266, [2] С.19-34, [3] С.72-76, [4] С.117-121, 129-133.
2.1 Термодинамічні потенціали
За зміною ентропії можна визначити напрямок і можливість перебігу самочинних процесів лише в ізольованих системах. Для характеристики фізико-хімічних процесів у відкритих системах застосовують інші термодинамічні функції.
Функція F = U – ТS є функцією стану системи, яка називається вільною енергією Гельмгольца або ізохорно-ізотермічним потенціалом.
Функція G = Н – Т·S є функцією стану системи, яка називається вільною енергією Гіббса або ізобарно-ізотермічним потенціалом.
Вільні енергії Гіббса і Гельмгольца є критеріями можливості самочинного перебігу фізико-хімічних процесів. Процес відбувається у системі, якщо: DG < 0 – для ізобарно-ізотермічних умов і DF < 0 – для ізохорно-ізотермічних умов.
За стандартних умов зміну вільної енергії системи під час перебігу хімічних реакцій розраховують за значеннями вільних енергій утворення речовин, які беруть у довідниках фізико-хімічних величин:
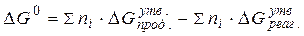 (3.1)
(3.1)
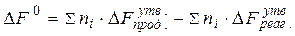 (3.2)
(3.2)
2.2 Хімічна рівновага
Усі хімічні реакції можна поділити на оборотні і необоротні. Реакцію відносять до оборотних, якщо в системі одночасно із взаємодією реагентів, яка призводить до утворення продуктів реакції (пряма реакція), відбувається перетворення продуктів назад у реагенти (зворотна реакція). Тобто, оборотні реакції складаються з двох реакцій, які перебігають у протилежних напрямках.
Хімічною рівновагою називається стан системи, коли швидкості прямої і зворотної реакцій однакові, а концентрації реагентів та продуктів реакції, які в цьому випадку називають рівноважними, не змінюються. Кількісною характеристикою стану рівноваги є константа рівноваги – величина, що дорівнює відношенню добутку концентрацій продуктів реакції, узятих у ступенях, що дорівнюють їх стехіометричним коефіцієнтам, до добутку концентрацій регентів у ступенях, рівних їх стехіометричним коефіцієнтам. Так, для реакції:
aA + bB ⇄ dD + rR
константа рівноваги, виражена через концентрації буде дорівнювати:
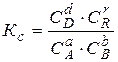 , (2.3)
, (2.3)
де СА , СВ, СD і CR – рівноважні концентрації відповідних реагуючих речовин.
Якщо ж у реакції приймають участь газоподібні речовини, то константу рівноваги (Кp) можна виражати через їх парціальні тиски. Зв'язок між Кp і Кс для оборотної хімічної реакції має вигляд:
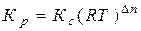 , (2.4)
, (2.4)
де Dn – різниця між кількістю молів газоподібних продуктів реакції і реагентів.
Хімічна рівновага носить динамічний характер і під час змін умов, за яких перебігає реакція, зміщується. Зміщення рівноваги відбувається за принципом Ле-Шательє: «Якщо на систему, що знаходиться в рівновазі чиниться зовнішня дія, то рівновага зміщується у бік тієї з двох протилежних реакцій, яка послаблює цю дію». Так, при збільшенні концентрації реагентів рівновага зміщується у бік утворення продуктів реакції, а при доданні в систему продуктів – у бік регентів. Підвищення тиску зміщує рівновагу у бік реакції, що йде із зменшенням числа молів газів, а зменшення тиску – навпаки. Підвищення температури зміщує рівновагу у бік ендотермічної реакції, зниження температури – у бік екзотермічної реакції.
3.3 Хімічна спорідненість
Для систем, де за сталого тиску (об'єму) і температури перебігають оборотні хімічні реакції, DG (DF) визначають за рівнянням ізотерми Вант-Гоффа:
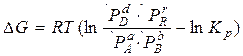 , (2.5)
, (2.5)
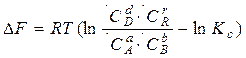 , (2.6)
, (2.6)
де 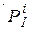 і
і 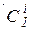 – нерівноважні парціальні тиски і концентрації реагентів і продуктів реакції. Якщо розраховані значення будуть негативним (DG<0 і DF<0) у системі перебігає пряма реакція, якщо ж DG>0 або DF>0, то має місце зворотна реакція; значення DG=0 або DF =0 відповідають досягненню стану рівноваги.
– нерівноважні парціальні тиски і концентрації реагентів і продуктів реакції. Якщо розраховані значення будуть негативним (DG<0 і DF<0) у системі перебігає пряма реакція, якщо ж DG>0 або DF>0, то має місце зворотна реакція; значення DG=0 або DF =0 відповідають досягненню стану рівноваги.
Величини DF і DG є критеріями хімічної спорідненості речовин – тобто їх здатності вступати у хімічну взаємодію. Чим більші значення DF і DG за абсолютною величиною, тим інтенсивніше йде реакція. Під час перебігу хімічних реакцій за стандартних умов, величини DG0 і DF0визначають за формулами:
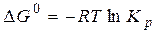 (2.7)
(2.7)
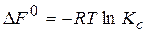 (2.8)
(2.8)
На лекції надаються приклади розрахунку констант рівноваги конкретних хімічних реакцій та зміщення рівноваги в цих реакціях при зміні умов їх перебігу.
Лекція №3
Термодинаміка фазових переходів
План лекції
1. Агрегатний стан речовин. Властивості речовин у різних агрегатних станах.
2. Фазові рівноваги. Правило фаз Гіббса. Фазові переходи. Хімічний потенціал речовин.
3. Фізико-хімічний аналіз. Принцип Курнікова. Діаграма стану води та її аналіз.
Рекомендована література: [1] С.238-254, [2] С.36-40, [3] С.42-57,
[4] С.106-111, 147-148.
Дата добавления: 2016-12-16; просмотров: 1072;
