Визначення вмісту хрому (VI) в розчинах кінетичним методом
1. Сутнiсть методики
Щоб визначити мiкрокiлькості хрому (VI), часто використовують реакцiю окислення о‑дiанiзидину iоном персульфату, на яку згаданий елемент дiє як каталiзатор. Окислення веде до сильно забарвленої сполуки в хиноїднiй формi,
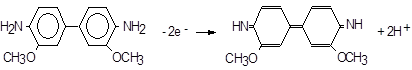
S2O82‑ + 2 e‑ Þ 2 SO42‑,
У вiдсутностi хрому (VI) реакцiя плине повiльно. При каталізаторі швидкiсть реакцiї збiльшується й описується рiвнянням
d x / d t = k {c(S2082‑) ‑ x} Cкат(c1 ‑ x), (1)
де x – концентрацiя продукту окислення, t – час перебiгу реакцiї, k – константа швидкостi, cкат– концентрацiя Cr (VI), c(S2O82‑) – концентрацiя персульфату, c1 – концентрацiя о‑дiанiзидину. На початку процесу доданком x можна знехтувати й рiвняння (1) зводиться до лiнiйного вiдносно концентрацiї каталiзатора
d x / d t = k c(S2082‑) cкат c1. (2)
Щоб визначити швидкiсть реакцiї, стежать за залежнiстю світлопоглинання A вiд часу. Для реакцiї, що ми використовуємо, початкова дiлянка кiнетичної кривої – залежностi A вiд t – лiнiйна, а значення танґенса кута нахилу є пропорцiйним швидкостi реакцiї.
Щоб визначити концентрацiю каталізатора, готують декiлька розчинiв з однаковими об'ємами, величиною pH, вмiстом о-дiанiзидину й персульфату амонiю, але зi змiнною концентрацiєю каталiзатора. За результатами вимiрювань A залежно вiд часу перебiгу реакцiї t будують для заданих концентрацiй каталiзатора кiнетичні криві й визначають танґенси кутів нахилу лiнiйної дiлянки цих кривих. Аналоґiчно дослiджують розчин, в якому концентрацiя каталізатора невiдома. Експериментальнi данi обробляють таким чином. Креслять кiнетичнi кривi в координатах A ‑ t для всiх дослiдiв. Ґрафiчно або розрахунком (дивись додаток: «Застосування проґрами MATCAD у розрахунках лабораторних робіт з фізико-хімічних методів аналізу») визначають величини танґенсiв кутiв нахилу на лiнiйних дiлянках кiнетичних кривих. За знайденими значеннями танґенсiв будують ґрадуювальний ґрафiк у координатах: танґенс - c. За ґрафiком можна визначити невiдому концентрацiю каталізатора в розчинi.
Алґоритм методики
2.1. Прилади та реагенти
Фотоелектрокалориметр КФК з мікропроцесором;
Вимiрювальнi колби мiсткiстю 50 мл;
Пiпетки мiсткiстю 2 мл;
Пiпетки з подiлками мiсткiстю 10 мл;
Розчин о-дiанiзидину, 0,0036 моль/л;
Розчин персульфату амонiю, 0,001 моль/л;
Розчин хлороводневої кислоти, 0,1 моль/л;
Стандартний розчин дихромату калiю з масовою концентрацiєю хрому (VI) 25 мкг/мл.
2.2. Побудова ґрадуювального ґрафiка
УВАГА! СУВОРО ДОТРИМУЙТЕСЬ ПОРЯДКУ ЗМIШУВАННЯ РОЗЧИНIВ РЕАГЕНТIВ!!! У декiлька вимiрювальних колб (№ 1, 2, ..., 6) уводять послідовно по 2 мл розчину персульфату амонію та змінні кількості стандартного розчину хрому(VI) - 0, 2, 4, 6, 8, 10 мл. Вони пiсля розведення в колбi дадуть масові концентрацiї хрому (VI) 0, 1, 2, 3, 4 й 5 мкг/мл. У кожну колбу додають розчин хлороводневої кислоти до початку звуження колби. У колбу № 1 вміщують 2 мл розчину о-дiанiзидину й вiдзначають час початку реакцiї. Якомога швидко доводять розчин у колбi до мiтки, додаючи хлороводневу кислоту. Розчин перемiшують протягом 30 с, вмiщують в кювету для фотометрування. Кювету встановлюють у фотоколориметр i вимiрюють залежнiсть оптичноi густини вiд часу, уводячи прилад у режим автоматичного видання результату через заданий промiжок часу. Оскільки у цьому режимі сиґнал виводиться занадто часто – через кожні 5 с, коли показання приладу істотньо не змінюються, фіксують кожне шосте показання (тобто через 30 с; можна час вимірювати і секундоміром, що придатне і для інших типів фотоколориметрів), знімають показання для кількох точок (близько 10-ти, і щонайменше для 6-ти). Аналоґiчнi вимiрювання здiйснюють для розчинiв № 2, 3, ... , 6. Показання приладу занотовують i використовують для побудови ґрафiків залежностi A вiд t.
2.3. Визначення концентрацiї хрому в дослiджуваному розчинi
Із розчином здiйснюють тi ж операцiї, що й зi стандартними. Визначивши танґенс кута нахилу для досліджуваного розчину перераховують його в концентрацiю хрому (VI) за ґрадуювальним ґрафiком. Радимо для розрахунків і побудови ґрафiків при можливості користуватися комп’ютером.
Література
1. Марк Г., Рехниц Г. Кинетика в аналитической химии. М.: Мир, 1972. − 368 с.
2. Мюллер Г., Отто М., Вернер Г. Каталитические методы в анализе следов элементов. М.: Мир, 1983. − 196 с.
3. Крейнгольд С.У. Каталитиметрия в анализе реактивов и веществ особой чистоты. М.: Химия, 1983. − 190 с.
Дата добавления: 2016-08-07; просмотров: 740;
