Вибрані кінетичні методи аналізу
У багатьох методах аналізу до стану рівноваги доводять хімічні перетворення, за якими аналіт переводять у інші сполуки, що формують вихідний сиґнал (масу чи об’єм, випромінювання чи світлопоглинання, електропровідність чи потенціал електроду тощо). Це здебільшого зручно, бо дозволяє, зокрема, не контролювати точно час протікання реакції, а також порівняно легко зберегти просте для розрахунків співвідношення між кількістю речовини аналіту та сполуки, що формує вихідний сиґнал, на засадах стехіометрії хімічних реакцій.
Однак, саме такий зв’язок зі стехіометрією утрудняє розробку методик для ультрамалих концентрацій аналіту. Наприклад, якщо вихідний сиґнал – світлопоглинання, то обмежені як коефіцієнт молярного світлопоглинання (найбільші значення – приблизно 105 л/(моль·см), так і довжина кювети (на практиці 1-10 см). Отже, для оптимальних значень світлопоглинання, 0,2 < А < 1,2 , потрібна концентрація сполуки, що поглинає світло, не менше ніж 10‑5 моль/л за порядком величини. А практичні можливості концентрування (з небезпекою забруднення та зі зростом трудомісткості методики!) також не є необмеженими.
Інша справа, якщо аналіт (або продукт, що утворився з нього у стехіометричних співвідношеннях) виступає у ролі каталізатора реакції, продукт якої формує вихідний сиґнал, хоч би уже згадане світлопоглинання. Після низки реакцій каталізатор, що бере в них участь, відновлюється і може брати участь у новому циклі реакцій. Практично використовують значення числа таких циклів (кругообертного числа), що дорівнює кільком сотням. Система, в якій протікає така каталітична реакція, нерівноважна. Але – уявіть собі – чи можна досягнути такого співвідношення між кількістю речовини аналіту і сполуки, що формує вихідний сиґнал, на основі стехіометричних співвідношень у рівноважних системах?!
Зрозуміло, що з кінетичними методами аналізу мають обов’язково ознайомитись студенти хімічних і біолоґічних спеціальностей (останнім ці методи близькі через роль ферментативних реакцій в біохімії).
У кінетичних методах залежність концентрації продукту від часу і концентрацій реаґентів визначає кінетичне рівняння. Конкретні види цих рівнянь наведено нижче стосовно певних лабораторних робіт. Якщо вимірюють концентрацію каталізатора, використовують здебільшого початковий період, де концентрації вихідних реагентів відносно майже не змінилася, і тому реакція – псевдопершого порядку, тобто концентрація продукту пропорційна часу перебігу реакції і концентрації каталізатора. У деяких реакціях доводиться враховувати наявність індукційного періоду, коли швидкість реакції ще не встигла досягнути сталої величини.
У каталіметрії використовують три види залежностей, що зумовлені кінетичним рівнянням. Їм відповідають три види ґрадуювання: за постійним часом, за постійним сиґналом і метод танґенсів.
Перший з цих методів, постійного часу, пояснено на наступних рисунках (сиґнал – світлопоглинання):
| Світлопоглинання продукту, А | 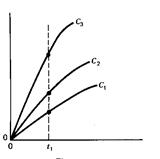
| Світлопоглинання при t1 | 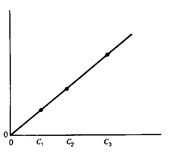
|
| Час, t | Концентрація каталізатора, c. |
Рисунок ліворуч пояснює принцип методу, він допоміжний. На ньому зображено залежності світлопоглинання від часу, різні криві відповідають різним концентраціям. Пунктирна лінія відповідає деякому вибраному часові, t1. Цей час відповідає лінійним ділянкам залежності, де реакція псевдопершого порядку. Рисунок праворуч − залежність світлопоглинання у момент t1 від концентрації каталізатора. Саме таку залежність визначають експериментально, вона є ґрадуювальним ґрафіком.
Другий з цих методів, постійного сиґналу, пояснено на наступних рисунках (сиґнал – світлопоглинання):
| Світлопоглинання продукту, А | 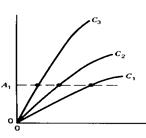
| Час реакції, потріб-ний щоб досягнутиА1 | 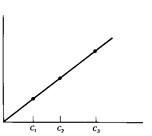
|
| Час, t | Концентрація каталізатора, c. |
І тут допоміжний рисунок ліворуч пояснює принцип методу. Від аналоґічного рисунка в описі методу постійного часу він відрізняється напрямом пунктирної лінії, що тут відповідає деякій вибраній величині світлопоглинання, А1. І тут вибрано лінійні ділянки залежності, де реакція псевдопершого порядку. Рисунок праворуч – залежність від концентрації каталізатора, c, часу, що потрібний, щоб світлопоглинання досягло величини А1. Саме таку залежність визначають експериментально, вона є ґрадуювальним ґрафіком.
Метод танґенсів дещо кропіткіший. У ньому будують експериментально ґрафіки залежнлсті сиґналу від часу, які в наведених вище описах попередніх методів ми вважали за пояснюючі, які будувати для ґрадуювання було не обов’язковим. Для експериментальних ґрафіків підраховують танґенси кутів нахилу лінійних відтинків, і власне вони є ординатами ґрадуйовочного ґрафіка методу танґенсів. Цей метод застосовано в одній із лабораторних робіт. Серію ґрафіків розглянуто у додатку «Застосування проґрами MATCAD у розрахунках лабораторних робіт із фізико-хімічних методів аналізу».
Ми висловлюємо подяку очолюваній доцентом І. Ф. Долмановою групі співробітників кафедри аналітичної хімії Московського університету – фахівців з кінетичних методів, що надали нам методики робіт, зручні для студентського практикуму.
Зауважимо, що, крім каталітичних, у хімічному аналізі використовують і некаталітичні реакції. До того ж, є важливими й інші нерівноважні процеси. Найпоширеніші з тих, що можуть включати або не включати хімічних реакцій, є хроматоґрафічне відокремлення аналітів, що ґрунтується на багаторазовій послідовності процесів сорбції і десорбції. Це відокремлення є надзвичайно ефективним і вирішує проблему багатокомпонентного аналізу з застосуванням неселективних датчиків, що реєструють вихідний сиґнал. Інший, нині модний приклад використання кінетичних явищ – проточно-інжекційний аналіз.
Дата добавления: 2016-08-07; просмотров: 898;
