Номенклатура комплексних сполук
Для створення назв за номенклатурою координаційних сполук треба виділити координаційні сфери-комплексні йони або нейтральні комплекси. Під час написання формул комплексів символ центрального атома (комплексоутворювача) вказують першим, за ним спочатку іонні, а потім нейтральні ліганди в алфавітному порядку відповідно. Комплексну частинку обмежують квадратними дужками. Назву комплексів починають із лігандів, які перелічують за алфавітом (українським), потім вказують центральний атом (комплексоутворювач).
Катіонні та нейтральні комплекси не одержують у назвах спеціальних закінчень, назви аніонних мають суфікс –ат, що додається до кореня назви центрального атома. У разі необхідності вказують ступінь окиснення центрального атома або заряд іона.
Назви катіонних та нейтральних лігандів не відрізняються від назв відповідних катіонів та молекул. Назви аніонних лігандів утворюють додаванням до назв аніонів закінчення –о. Узагалі, якщо назва аніона закінчується на –ід, -ид, -ат (в окремих випадках –іт, -ит), то після додавання закінчення –о утворюються відповідно –ідо, -идо, -ато (-іто, -ито):
Таблиця 2
Назви аніонних лігандів
| Формула | Аніон | Ліганд | Формула | Аніон | Ліганд | |
| F- | флуорид | флуоро- | O22- | пероксид | пероксо- | |
| Cl- | хлорид | хлоро- | S2- | сульфід | тіо- | |
| Br- | бромід | бромо- | CN- | ціацід | ціано- | |
| I- | іодид | іодо- | SO42- | сульфат | сульфато- | |
| O2- | оксид | оксо- | NO3- | нітрат | нітрато- | |
| H- | гідрид | гідридо- | N3- | нітрид | нітридо- | |
| OH- | гідроксид | гідроксидо- | N3- | азид | азидо- |
Назви координованих молекул (нейтральні ліганди) використовуються без змін та беруться у дужки. Лише координовані вода, амоніак, нітроген(II) оксид та карбон(II) оксид мають свої специфічні традиційні назви: аква, амін, нітрозил, карбоніл, які входять до назви комплексу без дужок.
Наприклад, Na3[Fe(CN)6] - натрій гексаціаноферат(III);
[Ag(NH3)2]Cl - діамінаргентум(I) хлорид;
K4[Fe(CN)6] - калій гексаціаноферат(II);
K[Cr(SO4)2] - калій дисульфатохромат;
[Co(H2O)2(NH3)4]Cl3 - діакватетраамінкобальт(ІІІ) хлорид.
Дисоціація та стійкість комплексів у розчинах
Внутрішня та зовнішня сфери комплексних сполук дуже відрізняються за стійкістю.
1.Первинна дисоціація (за типом дисоціації сильних електролітів):
[Ag(NH3)2]Cl®[Ag(NH3)2]++Cl-.
2.Вторинна дисоціація - зворотній розпад внутрішньої сфери:
[Ag(NH3)2]+ÛAg++2NH3.
Дисоціація характеризується наявністю рівноваги між комплексною частинкою, центральним іоном та лігандами. Дисоціація може бути охарактеризована константою рівноваги, яку називають константою нестійкості комплексного іона:
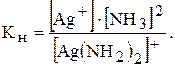
Константи нестійкості служать мірою стійкості комплексу.
Іноді для характеристики стійкості комплексних сполук користуються константою стійкості:
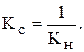
Застосування комплексних сполук у хімічному аналізі
· Визначення іонів
1. Комплексна сіль - натрій гексанітрокобальтат(III) Na3Co(NO2)6із калій-катіонами утворює жовтий дрібнокристалічний осад подвійної комплексної солі K2NaCo(NO2)6:
2KCl+Na3Co(NO2)6 → K2NaCo(NO2)6↓+2NaCl.
Присутність лугів заважає реакції, тому що луги розкладають реактив з утворенням темно-бурого осаду Co(OH)3:
Na3Co(NO2)6+3NaOH → 6NaNO2+Co(OH)3↓.
Амоній-катіон утворює з реактивом такий самий осад, як і калій-катіон. Утворенню подвійної солі K2NaCo(NO2)6 заважають і сильні кислоти, тому реакцію виявлення калій-катіонів за допомогою натрій гексанітрокобальтату(III) треба проводити за таких умов:
a) у слабокислому середовищі;
б) за відсутністю амоній-катіону;
в) більш-менш концентрованих розчинах калій-катіонів.
2.Комплексна сіль - калій гексагідроксостибат KSb(OH)6із розчинами солей натрію в нейтральному або слаболужному середовищі утворює білий кристалічний осад натрій гексагідроксостибату:
NaCl+KSb(OH)6 → NaSb(OH)6↓+KCl.
У кислому середовищі осад натрій гексагідроксостибату не утворюється, бо реактив KSb(OH)6 розкладається кислотами, утворюючи аморфний осад метасурмяної кислоти:
KSb(OH)6+HCl → HsbO3ּ3H2O↓+KCl.
Солі амонію також заважають проведенню реакції, бо вони гідролізуються, утворюючи гідроген-іони :
NH4++HOH → NH4OH+H+.
Під час проведення цієї реакції треба додержуватись таких умов:
1) концентрація солі натрію в розчині повинна бути досить високою (розведені розчини концентрують випарюванням);
2) реакцію проводять на холоді;
3) солі амонію повинні бути відсутніми;
4) реакцію треба проводити в нейтральному або слаболужному середовищі.
3. Реактив Несслера (суміш комплексної солі K2HgI4 і КОН ) утворює з амоній-катіоном червоно-бурий осад трийодидмеркурамонію NH2Hg2I3:
NH4Cl+2K2HgI4+2КОН→ NH2Hg2I3↓+5KI+KCl+2H2O.
Реакція дуже чутлива і може бути використана для виявлення навіть слідів амоній-катіонів.
Умови проведення досліду: а) необхідно брати надлишок реактиву Несслера, тому що осад розчиняється в солях амонію; б) виявленню амоній-катіонів заважають катіони Fe3+, Cr3+, Co2+, Ni2+ та ін.
4. Їдкі луги з іоном Cr3+ утворюють сіро-зелений осад хром(III) гідроксиду, який має амфотерні властивості і тому розчиняється в кислотах та надлишку лугу з утворенням комплексної сполуки, що може мати змінний склад: Na[Cr(OH)4] або Na3[Cr(OH)6].
CrCl3+3NaOH®Cr(OH)3↓+3NaCl,
Cr(OH)3↓+3HCl®CrCl3+3H2O,
Cr(OH)3↓+NaOH®Na[Cr(OH)4].
5. Калій гексаціаноферат(II) K4[Fe(CN)6] утворює з катіоном Zn2+ білий осад трицинкдикалій гексаціаноферату(II), який не розчиняється в кислотах, а з лугами утворює цинкат:
3ZnCl2+2K4[Fe(CN)6] ® Zn3K2[Fe(CN)6]2¯+6KCl.
За допомогою цієї реакції можна розпізнати цинк-катіон у присутності алюміній-катіону.
6. Калій гексаціаноферат(III) K3[Fe(CN)6] утворює з Fe 2+-іоном темно-синій осад ферум(II) гексаціаноферату(III) Fe3[Fe(CN)6]2, що носить назву “турнбульової сині”:
3FeSO4 +2K3[Fe(CN)6] ® Fe3[Fe(CN)6]2¯+3K2SO4.
Ця реакція є характерною для Fe2+-іону, Fe3+-іони та інші не заважають її проведенню. Турнбульова синь не розчиняється у кислотах, але розкладається лугами з утворенням гідроксиду.
7. Калій гексаціаноферат(II) K4[Fe(CN)6]утворює з Fe(III)-катіоном комплексну сполуку ферум(III) гексаціаноферат(II) так звану “берлінську блакить”. Ця реакція є характерною для Fe(III)-катіону, Fe(II)-катіон та інші не заважають її проведенню. Реакція відбувається за таким рівнянням:
4FeCl3+3K4[Fe(CN)6] ® Fe4[Fe(CN)6]3¯+12KCl.
Під час проведення реакції слід дотримуватись таких умов: а) реакцію необхідно проводити у кислому середовищі за рН< 3 (вільні луги розкладають берлінську блакить); б) надлишку K4[Fe(CN)6] не повинно бути, тому що при цьому можуть утворюватись розчинні форми берлінської блакиті.
8. Калій або амоній тіоціонат ( KSCN або NH4SCN) із ферум(3+)- іонами утворює ряд забарвлених у червоний колір розчинних комплексних сполук: [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]-, [Fe(SCN)5]2-, [Fe(SCN)6]3-. Ця реакція характерна для іона Fe3+, іони Fe2+ не заважають її проведенню. Реакція досить чутлива і її можна проводити на смужці фільтрувального паперу.
9. Калій гексаціаноферат(II) K4Fe(CN)6утворює з купрум(2+)-іонами червоно-бурий осад, який не розчиняється в розбавлених кислотах і розкладається лугами.
СuSO4+ K4Fe(CN)6 → Cu2 Fe(CN)6↓+K2SO4.
· Розділення іонів
Наприклад, для того щоб визначити аргентум-катіон у розчині, який містить суміш катіонів першої групи, можна подіяти на досліджуваний розчин хлоридною кислотою. При цьому утвориться білий осад аргентум хлориду:
KCl+AgNO3®AgCl¯+KNO3.
Під час нагрівання аргентум хлорид розчиняється в концентрованих розчинах хлоридів лужних металів і в концентрованій хлоридній кислоті з утворенням комплексних іонів [AgCl3]2-.
Реакція розчинення аргентум хлориду в амоніаку з утворенням комплексного амоніакату відбувається за таким рівнянням:
AgCl↓+2NH3® [Ag(NH3)2]Cl.
Якщо до утвореного амоніачного розчину додати кислоту, то знову випадає осад аргентум хлориду:
[Ag(NH3)2]Cl+2HNO3®AgCl¯+2NH4NO3.
· Маскування іонів
1. Калій або амонію тіоціанат NH4SCN утворює з кобальт(2+)-іонами забарвлену у синій колір комплексну сполуку:
CoCl2+4NH4SCN → (NH4)2Co(SCN)4 +2NH4Cl.
Комплексна сполука - амоній тетратіоціанокобальтат(II) - стійка у присутності ацетону. Цій реакції заважає ферум(3+)-іон, який з амоній тіоціанатом утворює комплексну сполуку червоного кольору. У таких випадках ферум(3+)-іон зв'язують, додаючи амоній фторид, який утворює з ферум(3+)-іоном досить стійкій безбарвний комплекс ([FeF6]3-).
2. У ході аналізу катіонів п’ятої групи кадмій-катіон відкривають за допомогою сірководню у вигляді жовтого осаду кадмій сульфіду, але виконанню цієї реакції заважає купрум(ІІ)-катіон, який з цим реактивом дає чорний купрум(ІІ) сульфід:
Cd(NO3)2+H2S=CdS¯+2HNO3,
CuSO4+H2S=CuS¯+H2SO4.
Для маскування купрум(ІІ)-катіонів до досліджуваного розчину додають калій ціанід. Концентрація купрум(ІІ)-катіонів знижується внаслідок утворення комплексного комплексу [Сu(CN)4]3-:
Сu2++4CN-=[Сu(CN)4]3-.
· Розчинення сполук
Комплексоутворення використовують для переводу у розчин деяких малорозчинних сполук (AgCl, AgBr, HgI2, Fe(CN)3 та інші). Для цього використовують розчини амоніаку, тіосільфатів, йодидів, ціанідів, наприклад,
AgCl+2NH4OH=[Ag(NH3)2]Cl+2H2O, HgI2+2KI=K2[HgI4],
AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr, Fe(CN)3+3KCN=K3[Fe(CN)6].
Література: [2], с. 96-97; [3], т. 1, с. 138-159; [4], т. 1 с. 179-211
РІВНОВАГА ПРИ ПЕРЕБІГУ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ
Лекція №11 (2 години)
План
1. Типи окисно-відновних реакцій (ОВР).
2. Гальванічні елементи.
3. Напрямок реакцій окиснення-відновлення.
4. Використання окисно-відновних реакцій у хімічному аналізі.
Типи окисно-відновних реакцій (ОВР)
Реакції, в результаті яких змінюються ступені окислення елементів, називають окисно-відновними реакціями (ОВР).
Найважливіші окисники та відновники:
Окисники - сполуки вищих, а відновники - сполуки нижчих ступенів окислення, які може мати даний іон.
Метали проявляють тільки відновні властивості. Якщо метал може мати декілька ступеней окиснення , то ті його сполуки, в яких він проявляє нижчу з них, звичайно, є відновниками (наприклад, Fe2+, Sn2+, Cr2+, Cu+). Окисники ¾ сполуки металів, в яких ступінь окиснення металу дорівнює номеру групи, в якій знаходиться метал чи близька до нього (наприклад, FeCl3, K2CrO4, K2Cr2O7, KMnO4, MnO2 та інші).
Неметали проявляють позитивну чи негативну окисненість. Тому сполуки, які містять неметал у вищих позитивних ступенях окиснення - окисники, а сполуки, в яких неметал проявляє негативну окисненість - відновники.
Окисно-відновні реакції підрозділяють таким чином:
а) реакції диспропорціонування (самоокиснення-самовідновнення). Характерні для сполук, які містять елементи в проміжних ступенях окиснення.
б) реакції внутримолекулярного окиснення-відновлення.
Для сполук, які містять елементи в проміжних ступенях окиснення, характерна окисно-відновна подвійність.
Складання ОВР:
· Скласти схему реакції та вказати вихідні та кінцеві речовини.
· Визначити ступені окиснення елементів у речовинах; відмітити ті речовини, ступінь окиснення яких змінюється.
· Скласти рівняння процесів відновлення та окиснення. Знайти число електронів, що приймають участь під час відновлення та окиснення.
· Скласти рівняння окиснення та відновлення з урахуванням знайденого відношення числа електронів.
Гальванічні елементи
Електрод ¾ сукупність двох контактуючих фаз, одна з яких обов’язково є провідником другого роду (розчином або розплавом електроліту), а друга може бути металевим провідником, напівпровідником. На межі розподілу фаз виникає стрибок потенціалу, який обумовлено електродною реакцією.
Гальванічні елементи - системи, в яких відбувається перетворення енергії хімічної реакції в електричну енергію. Напівреакції, які перебігають на відповідному електроді називають електродними процесами.
Кожен електрод має потенціал, який розраховують за рівнянням Нернста:
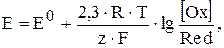
де Е0 - стандартний електродний потенціал, мВ;
F - число Фарадея (96500 Кл/моль);
R - газова стала (8,31 Дж/(моль×К);
Z - кількість електронів, що приймали участь у реакції;
[Ox] - рівноважна концентрація окисненої форми, моль/л;
[Red] - рівноважна концентрація відновленої форми, моль/л.
Рівняння Нернста після спрощення можна записати в наступному вигляді:
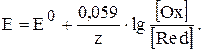
Напрямок реакцій окиснення-відновлення
На перебіг ОВР можуть впливати різні фактори:
· Концентрація реагуючих речовин.
· Температура.
· рН середовища.
Використання окисно-відновних реакцій у хімічному аналізі
Окисно-відновні реакції широко застосовуються для якісного визначення катіонів та аніонів.
· Відкриття іонів
1. Наприклад, під час визначення хром(III)-катіонів можна використати їх здатність окиснюватись сильними окисниками у лужному середовищі до іона CrO42-, у кислому - до Cr2O72-.
а) окиснення катіону Cr3+ в лужному середовищі до іона CrO42-:
Найчастіше окиснення проводять гідроген пероксидом або натрій пероксидом. Реакція відбувається за таким рівнянням:
Cr2(SO4)3+3H2O2+10NaOH ® 2Na2CrO4+3Na2SO4+8H2O.
2Cr3+ + 8OH--3е ® CrO42-+4H2O 2 (окиснення)
H2O2+2H++2е ® 2H2O 3 (відновлення)
2Cr 3++3H2O2+10OH- ® 2CrO42-+8H2O.
б) окиснення катіону Cr3+ в кислому середовищі до іона Cr2O72-:
Для проведення реакції краще використати калій тетраоксоманганат(VII) KMnO4 у присутності сульфатної або нітратної кислот, хлоридна кислота сама окиснюється сильними окисниками.
Реакція відбувається за таким рівнянням:
5Cr2(SO4)3+6KMnO4+11H2O ® 5H2Cr2O7+6MnSO4+3K2SO4+6H2SO4
2Cr3+ + 7H2O-6е ® Cr2O72-+14H+ 5
MnO4-+8H++5е ® Mn2++4H2O 6
10 Cr3++6MnO4-+11H2O ® 5Cr2O72-+6Mn2++22H+.
Іони Cr2O72- у кислому середовищі взаємодіють із гідроген пероксидом і утворюють хром пероксид синього кольору:
K2Cr2O7+4H2O2+H2SO4 ® 2CrO5+K2SO4+5H2O.
Хром пероксид розчиняється у воді, утворюючи надхромову кислоту H2CrO6.
2. Окиснення катіону Mn2+ в аніон MnO4- використовується для виявлення й відокремлення мангану від інших елементів, а також для кількісного визначення мангану. Катіон Mn2+ можна окиснити плюмбум діоксидом та іншими окисниками.
· На окисно-відновних реакціях базується ряд методів кількісного аналізу (перманганатометрія, йодометрія, хроматометрія та інші).
Література: [1] с.50-54; [3] т.1, с.177-192; [4], т.1, с.146-171
СИСТЕМАТИЧНИЙ АНАЛІЗ КАТІОНІВ ТА АНІОНІВ
Лекції №12,13 (4 години)
План
1. Якісний хімічний аналіз.
2. Реакції, що застосовуються в якісному аналізі.
3. Різновиди аналітичних класифікацій катіонів за групами.
4. Розподіл катіонів на аналітичні групи за кислотно-лужною класифікацією.
5. Систематичний аналіз катіонів першої аналітичної групи.
6. Систематичний аналіз катіонів четвертої аналітичної групи.
7. Якісний аналіз аніонів.
8. Систематичний аналіз аніонів I-III аналітичних груп.
Якісний хімічний аналіз
Предмет та методи аналітичної хімії
Аналітична хімія - наука, яка розробляє теоретичні основи та методи кількісного аналізу. Практична задача аналітичної хімії - встановлення хімічного складу речовин та їх сумішей. Спочатку встановлюють якісний склад речовини, тобто вирішують питання, із яких елементів, груп елементів чи іонів складається ця речовина, а потім визначають кількісний склад: визначають, в яких кількісних співвідношеннях знайдені складові частини знаходяться в даній речовині.
Задача якісного аналізу - визначення вмісту складових частин досліджуваної речовини. Якісний аналіз, звичайно, йде перед кількісним.
Задачі якісного аналізу можуть бути вирішені за допомогою різних методів: хімічних, фізичних та фізико-хімічних.
У хімічних методах якісного аналізу елемент чи іон, який визначають, переводять у яку-небудь сполуку, що має ті чи інші характерні властивості, на підставі яких можна встановити, що утворилась саме ця сполука. Хімічне перетворення, яке протікає називають аналітичною реакцією, а речовину, яка його викликає - реагентом.
Фізичні методи базуються на вимірюванні будь-якого параметра системи, який є функцією складу (спектральний, люмінесцентний аналізи).
Фізико-хімічні методи (колориметричні) - засновані на залежності інтенсивності забарвлення розчину від концентрації забарвленого іона, а також хроматографічний.
Для хімічного аналізу речовин беруть різні кількості досліджуваного розчину і відповідно до цього, різну кількість реактивів. Метод аналізу, для якого беруть 0,1-1 г речовини, називається макрометодом, якщо використовують менше 0,01 г речовини - мікрометодом. Проміжний метод аналізу називається напівмікрометодом. У більшості випадків користуються напівмікрометодом. Існує й ультрамікрометод, коли для аналізу беруть дуже малу кількість речовини, а зовнішній ефект реакції спостерігають під мікроскопом.
Для проведення реакції можна використати одну або кілька краплин розчину досліджуваної речовини на смужках фільтрувального паперу або на годинниковому скельці. Такий метод називається краплинним. Для відкриття того чи іншого іона можна використовувати реакції, в результаті яких утворюються кристали певної форми. Такий метод називається мікрокристалоскопічним. Спостерігають за формою кристалів за допомогою мікроскопа або лупи.
Таблиця 3
Класифікація методів якісного аналізу за кількістю речовини, яку аналізують
| Метод аналізу | Кількість досліджуваної речовини | Посуд для проведення аналізу | |
| твердої | рідини | ||
| Макроаналіз | 0,5-1 г | 20-50 мл | пробірки, хімічні стакани, колби |
| Напівмікроаналіз | 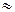 50 мг 50 мг
| 1 мл | пробірки |
| Мікроаналіз | <50 мг | <1 мл | фільтрувальний папір, годинникові скельця, мікроскоп та лупа |
| Ультрамікроаналіз | <1 мг | <0,1 мл | мікроскоп, скельця |
Реакції, що застосовуються в якісному аналізі
Під час аналізу речовини користуються реакціями, характерними для того чи іншого іона в присутності сторонніх іонів. У тих випадках, коли для якогось іона немає відповідних характерних реакцій, застосовують попереднє розділення іонів.
Вимоги до реакцій якісного аналізу
В якісному аналізу знаходять застосування тільки ті реакції, які супроводжуються яким-небудь зовнішнім ефектом, а саме:
а) зміною кольору розчину;
б) осадження (чи розчинення);
в) виділення газу.
Способи виконання аналітичних реакцій
Вміст того чи іншого компонента можна виявити, не переводячи досліджувану речовину в розчин. Для виявлення натрій-іона невелику кількість сухої речовини вносять на платиновій дротинці у безбарвне полум’я. Якщо в досліджуваній речовині міститься натрій-іон, то полум’я забарвлюється в жовтий колір. Калій забарвлює полум’я у фіолетовий колір і т.д. Такий метод аналізу називають “сухим методом”. Він широко використовується за польових умов. Різновидами “сухого” методу є спектральний метод аналізу, метод розтирання порошків та ін.
Якісний аналіз мокрим способом зводиться до виявлення катіонів і аніонів у розчинах солей, основ і кислот. Якісне виявлення іонів у розчині можна виконувати дрібним (кожний іон виявляють характерними реакціями в присутності інших іонів) і систематичним (складну суміш іонів розділяють на окремі групи, в межах яких виявляють окремі іони) методами аналізу.
Виконання дрібного аналізу вимагає від хіміка високої кваліфікації і великого практичного досвіду.
Застосування систематичного методу аналізу передбачає розділення іонів на групи й виявлення їх у кожній групі в цілком певній послідовності, що виключає помилки, які може зробити недосвідчений лаборант, проводячи аналіз дрібним методом. Розділення іонів на групи в систематичному ході аналізу застосовується тільки під час виявлення катіонів. Аналіз аніонів проводиться за іншою схемою.
Умови виконання реакцій
a) відповідне середовище
Наприклад, для виявлення кальцій(ІІ)-катіонів можна використовувати реакцію з амоній оксалатом:
Ca2+_+C2O42 -® CaC2O4.
Якщо під час перебігу реакції утворюється білий осад, це свідчить про наявність кальцій(ІІ)-катіонів у розчині. Але кальцій оксалат розчиняється у сильних кислотах, тому середовище не повинно бути кислим.
b) температура розчину
Наприклад, під час виявлення амоній-катіонів за допомогою лугу реакцію слід проводити за умов нагрівання. Поява запаху амоніаку свідчить про присутність амоній-катіонів у розчині.
c) достатньо висока концентрація іону, що визначають
Осад випадає тільки за умови, що продукту реакції одержують більше, ніж його може міститись у насиченому розчині. Якщо сполука, що утворюється малорозчинна і випадає в осад при невеликій концентрації іона, що визначають, то кажуть, що реакція високочутлива.
d) реакція повинна бути чутливою
Чутливість кількісно визначається за допомогою двох величин.
а) мінімум, що відкривають - найменша кількість йону, яку можна визначити за допомогою цієї реакції. Позначається m (вимірюється у мкг).
б) мінімальна концентрація - величина, яка показує при якому розбавленні розчину реакція ще дає позитивний результат.
Зв’язок між величинами: С=1: 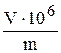 .
.
Наприклад, встановлено, що у 0,03 мл розчину можна визначити не менше 0,15 мкг Pb2+ у вигляді PbCrO4. Значить m=0,15 мкг.
С=1: 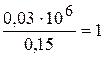 :
: 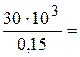 1:200000.
1:200000.
Це означає, що на 1 г Pb2+ у розчині може бути не більше 200000 мл води.
В якісному аналізі застосовуються ті реакції, відкриваємий мінімум яких не більше 50 мкг, а С<1:1000.
Чутливість реакції залежить від концентрації реагентів, часу перебігу, відповідного середовища та температури, додавання органічних розчинників.
Методи збільшення чутливості реакції
Чутливість реакції збільшується, якщо збільшити концентрацію іона у розчині.
а) метод іонного обміну. Для концентрування іонів використовують іонообмінні смоли (іоніти). Катіоніти - поглинають катіони, аніоніти - аніони.
б) метод екстрагування. Екстракція - один із видів фазового відділення речовин. Вона базується на тому, що деякі розчинники, які не змішуються з водою, мають властивість “вилучати” із водних розчинів компоненти сумішей.
Згідно із законом розподілу у рівноважній системі, що складається з двох рідин, що не змішуються, відношення концентрацій розчинених речовин є величина стала і називається коефіцієнтом розподілу:
К= 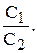
Наприклад, кобальт(2+)-іони можна виявити реакцією з калій або амоній тіоціанат NH4SCN. Під час перебігу реакції утворюється комплексна сполука синього кольору:
CoCl2+4NH4SCN → (NH4)2[Co(SCN)4] +2NH4Cl.
Комплексна сполука - амоній тетратіоціанокобальтат(II) - стійка у присутності ацетону.
У пробірку наливають 0,25-0,5 мл досліджуваного розчину, добавляють 0,25-0,5 мл насиченого розчину амоній тіоціанату, 0,5 мл суміші амілового спирту і ефіру (1:1), суміш взбовтують. У присутності кобальту неводний шар після відстоювання забарвлюється в синій колір.
в) застосування соосадження для збільшення чутливості.
У розчин, який містить незначну кількість визначаємого іону вводять сторонній іон, який і осаджують у вигляді малорозчинної сполуки. При цьому соосаджуються і залишки визначаємого іону. Осаджувач буває неорганічним та органічним. Органічні осаджувачі кращі, тому що мають високу селективність. Крім того, їх легко озолити й одержати елементи в чистому вигляді.
Поряд із чутливістю реакцій велике значення для аналізу має їх специфічність.
Специфічною реакцією на даний іон називається така реакція, яка дозволяє виявити його в умовах досліду у суміші з іншими іонами.
Специфічною реакцією є реакція якісного виявлення іона амонію за допомогою лугу, їй не заважають ніякі інші іони. На жаль, таких високо специфічних реакцій дуже мало. Ось чому під час розробки методів виявлення різних іонів передбачається відокремлення та зв’язування сторонніх іонів.
Відбіркові (селективні) реакції - реакції, що дають подібний ефект лише з певним числом іонів.
Різновиди аналітичних класифікацій катіонів за групами
Однією з найбільш розповсюджених класифікацій є класифікація, яка базується на властивостях сульфідів. Цей метод називається сірководневим.
Таблиця 4
Сірководнева класифікація катіонів
| Сульфіди розчинні у воді | Сульфіди нерозчинні у воді (чи замість них утворюються нерозчинні у воді гідроокиси) | |||
| Карбонати розчинні у воді | Карбонати нерозчинні у воді | Сульфіди розчинні в розбавлених кислотах | Сульфіди нерозчинні в розбавлених кислотах | |
| I група | II група | III група | IV група | V група |
 Na+, NH4+, Mg2+, та ін. Na+, NH4+, Mg2+, та ін.
| Ba2+, Sr2+, Ca2+ та ін. | Al3+, Cr3+, Tiiv, Fe3+, Fe2+, Mn2+, Zn2+, Co2+, Ni2+ та ін. | а) 1 підгрупа (суль-фіди не утворюють тіосолей при дії (NH4)2Sn): Cu2+, Cd2+, Bi3+, Hg2+, Pb2+ та ін. б) 2 підгрупа (сульфі-ди розчиняються в (NH4)2Sn з утворен-ням тіосолей): AsV, AsIII, SbV, SbIII, SnIV, SnII та ін. | Хлориди не розчиняються у воді та розбавлених кислотах Ag+, Hg22+, Pb2+ та ін. |
| Групового реагенту не мають | Груповий реагент (NH4)2CO3 | Груповий реагент (NH4)2S | Груповий реагент H2S у присутності HCl | Груповий реагент HCl |
Таким чином, в основу класифікації іонів в аналітичній хімії покладена різниця в розчинності утворених ними сполук, що дає можливість відділяти одні групи іонів від інших. Ця розчинність функціонально пов'язана з положенням відповідних елементів у періодичній системі.
Цей метод має ряд недоліків:
· Застосування сірководню (шкідливо для здоров’я).
· Розділення не дуже точне внаслідок явищ соосадження та послідуючого осадження.
· Під час осадження сульфідів велике значення має регулювання рН та ін.
Різні вчені роблять багаточисленні спроби замінити сірководневий метод яким-небудь другим, достатньо задовільним методом систематичного аналізу без застосування сірководню.
Існує метод, який базується на використанні різниці у властивостях гідроокисів металів, а також на різній розчинності утворених ними хлоридів і сульфатів. Така класифікація називається кислотно-лужною.
Розподіл катіонів на аналітичні групи за кислотно-лужною класифікацією
Для зручності проведення аналізу катіони поділяють на окремі аналітичні групи. Аналітична група - це група катіонів, яка з певним реактивом (за певних умов) дає подібні аналітичні реакції.
За кислотно-лужною класифікацією катіони розподіляються на групи щодо їх відношення до сульфатної, хлоридної кислот, їдких лугів та до амоніаку (табл. 5).
Катіони першої групи (Ag+, Pb2+, Hg22+) осаджуються хлоридною кислотою.
Катіони другої групи (Ba2+, Sr2+, Ca2+) осаджуються сульфатною кислотою.
Третю групу утворюють катіони (Zn2+, Al3+, Cr3+, Sn2+, Sn(IV), As(III), As(V)), які не випадають в осад під час додавання надлишку лугу.
Катіони четвертої групи (Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, Sb(III), Sb(V)) осаджуються розчином лугу.
П’яту групу утворюють катіони (Hg2+, Cu2+, Cd2+, Co2+, Ni2+), що утворюють гідроксиди, розчинні в надлишку 25%-го розчину амоніаку (утворюються амоніакати).
Шоста група катіонів (K+, Na+, NH4+) не має групового реактиву, катіони цієї групи не осаджуються ні мінеральними кислотами, ні лугами.
Таблиця 5
Розподіл катіонів на аналітичні групи
| Група | Катіони | Груповий реактив | Сполуки, що утворюються | Групова характеристика |
| 1. | Ag+, Pb2+, Hg22+ | 2 н. розчин HCl | Осад AgCl, PbCl2, Hg2Cl2 | Хлориди, що не розчиняються у воді |
| 2. | Ba2+, Sr2+, Ca2+ | 2 н. розчин H2SO4 | Осад BaSO4, SrSO4, CaSO4 | Сульфати, що не розчиняються (або погано розчиняються) у воді та кислотах |
| 3. | Zn2+, Al3+, Cr3+, Sn2+, Sn(IV), As(III), As(V) | Надлишок 4 н. розчину NaOH або KOH | Розчин ZnO22-, AlO2-, CrO2-, SnO22-, AsO33-, AsO43- | Гідроксиди, що розчиняються у надлишку їдких лугів |
| 4. | Mg2+, Mn2+, Bi3+, Fe2+, Fe3+, Sb(III), Sb(V) | Надлишок 25% розчину NH3 | Осад Mg(OH)2, Mn(OH)2, Bi(OH)3, Fe(OH)2, Fe(OH)3, Sb(OH)3, HSb(OH)6 | Гідроксиди, що не розчиняються у надлишку їдких лугів |
| 5. | Cu2+, Hg2+, Cd2+, Co2+, Ni2+ | Надлишок 25% розчину NH3 | Розчин Cu(NH3)42+, Hg(NH3)42+, Cd(NH3)42+, Co(NH3)42+`, Ni(NH3)62+ | Гідроксиди, що розчиняються у надлишку розчину амоніаку з утворенням амоніакатів |
| 6. | K+, Na+, NH4+ | немає | - | Хлориди, сульфати і гідроксиди розчиняються у воді |
Систематичний аналіз катіонів першої аналітичної групи
Немає жодного реактиву, яким би можна було виявити той чи інший катіон першої аналітичної групи в присутності інших катіонів. Тому для аналізу катіонів першої аналітичної групи необхідно поступово виділити кожний катіон із суміші, а потім його виявляти.
Хід роботи
· У конічну колбу поміщають досліджуваний розчин, додають 2 н. розчин хлоридної кислоти. Утворений осад хлоридів центрифугують і промивають холодною водою. Центрифугат та промивні води не використовують.
· Промитий осад обробляють гарячою водою: плюмбум (II) хлорид переходить у розчин, а аргентум і меркурій(I) хлориди залишаються в осаді.
· У центрифугаті відкривають катіон Pb2+. Краще це зробити за допомогою калій йодиду. При наявності іона Pb2+ утворюється жовтий осад PbI2, який за умов нагрівання розчиняється, а за умов охолодження знову випадає у вигляді золотистих кристалів.
· В осаді виявляють катіони Ag+ та Hg22+. Для цього до осаду приливають краплями розчин амоніаку. Якщо присутні катіони Hg22+, то осад почорніє. Аргентум хлорид під дією амоніаку переходить у розчин у вигляді комплексного амоніакату [Ag(NH3)2]+, а сіль [HgNH2]Cl і ртуть залишаються в осаді. Осад відокремлюють.
· Центрифугат розділяють на дві частини , до однієї з них додають калій іодид , до іншої – нітратну кислоту. Якщо аргентум-катіони присутні у розчині, то у першому випадку утвориться жовтий осад аргентум йодиду AgI, у другому – білий осад аргентум хлориду AgCl: [Ag(NH3)2]Cl+2HNO3®AgCl¯+2NH4NO3.
Систематичний аналіз катіонів четвертої аналітичної групи
Під час систематичного ходу аналізу суміші катіонів четвертої аналітичної групи враховуються такі їх особливості: гідроліз солей бісмуту й стибію, розчинність основних солей бісмуту у винній кислоті, нерозчинність мангану діоксиду у розведеній нітратній кислоті та розчинність в амоній хлориді магній гідроксиду.
Хід роботи
· З окремих проб досліджуваного розчину виявляють ферум(II)-катіони і ферум(III)-катіони у присутності всіх інших катіонів четвертої аналітичної групи: ферум(II)-катіон за допомогою калій гексаціаноферату(III), ферум(III)-катіон - калій гексаціаноферату(II).
· Якщо катіони четвертої аналітичної групи в досліджуваному розчині містяться у вигляді осаду гідроксидів, то його розчиняють у хлоридній кислоті, доводять рН до 6, а потім додають п'ятикратний об'єм дистильованої води. У присутності солей бісмуту й стибію випадає осад їх основних солей (SbOCl і BiOCl), який відділяють центрифугуванням і обробляють винною кислотою.
· Основні солі і стибій гідроксид розчиняються у винній кислоті. У виннокислому розчині виявляють стибій(3+)-іони за допомогою характерних реакцій.
· Осад, що містить основну сіль бісмуту, розчиняють у концентрованій хлоридній кислоті і відкривають бісмут(III)-катіон cтанум(II) хлоридом у лужному розчині.
· Центрифугат, що містить ферум(II)-, ферум(III)-, манган(II)- і магній-катіони, обробляють розчином їдкого лугу, додають гідроген пероксид , нагрівають.
· Осад, що містить ферум(III) гідроксид, манган діоксид, магній гідроксид, відокремлюють центрифугуванням і обробляють для розчинення магній гідроксиду амоній хлоридом. Магній-катіони виявляють у центрифугаті за допомогою динатрій гідрогенфосфату.
· Осад суміші ферум(III) гідроксиду й манган діоксиду обробляють розведеною нітратною кислотою для розчинення Fe(OH)3, ферум(3+)-іони виявляють характерними реакціями в добутому розчині.
· Осад манган діоксиду розчиняють у хлоридній або сульфатній кислоті і виявляють манган-катіон реакцією окиснення його до аніона MnO4-.
Якісний аналіз аніонів
Аналіз аніонів відрізняється від аналізу катіонів. У більшості випадків аніони виявляють дрібним методом, тобто за допомогою окремих реакцій. Аніони розділяють тільки тоді, коли виявленню одного заважає інший.
Аніони поділяють на аналітичні групи. Групові реактиви використовують не для відокремлення групи аніонів, а для того, щоб зробити висновок: чи варто далі проводити реакції для виявлення кожного з іонів даної групи.
В основу класифікації аніонів покладена різна розчинність солей барію та аргентуму. Усі аніони можна поділити на три аналітичні групи.
Таблиця 6
Класифікація аніонів
| Група | Аніони | Груповий реактив | Характеристика групи |
| SO42-, SO32-, CO32-, SiO32-,PO43-, AsO43-, S2O32-, BO2-, CrO42- | BaCl2 у нейтральному або слабко лужному розчині | Солі барію нерозчинні у воді | |
| Cl-, Br-, I-, S2- | AgNO3 у присутності HNO3 | Солі аргентуму нерозчинні у воді і розведеній нітратній кислоті | |
| NO3-, NO2-, CH3COO- | немає | Солі барію й аргентуму розчинні у воді |
До першої аналітичної групи належать аніони, які з барій-катіонами утворюють практично нерозчинні у воді солі. Це такі аніони: SO42-, SO32-, PO43-, CO32-, SiO32-, BO2-, AsO43-, AsO2-, S2O32-, CrO42-, Cr2O72-, MnO4-.
До другої аналітичної групи належать аніони, які з аргентум-катіонами утворюють солі, що погано розчиняються у воді і в розведеній нітратній кислоті. Це такі аніони: S2-, Cl-, Br-, I-, SCN-.
До третьої аналітичної групи належать аніони, які не утворюють важкорозчинних солей з барій- та аргентум- катіонами. Сюди відносять аніони, які виявляють окисні властивості: NO3-, NO2-, ClO3-, CH3COO-.
Третя аналітична група не має групового реактиву. Щоб прискорити процес виявлення аніонів третьої аналітичної групи, до невеликого об'єму досліджуваного розчину добавляють краплями розчин дифеніламіну в концентрованій сульфатній кислоті. У присутності аніонів окисників у досліджуваному розчині з'являється інтенсивне забарвлення. Якщо такого забарвлення немає, то за відсутністю хромат-іонів можна зробити висновок, що всі аніони третьої аналітичної групи, крім етаноат-аніонів, відсутні.
Якщо досліджуваному розчині присутні хромат-іони, то перед дослідом із дифеніламіном їх треба відокремити (барій хлоридом).
Систематичний аналіз аніонів I-III аналітичних груп
Під час аналізу суміші аніонів використовують не систематичний хід аналізу, а розподіл їх на аналітичні групи, щоб зробити висновок про наявність тієї чи іншої групи аніонів. Після цього за допомогою окремих реакцій виявляють всі аніони. Крім групових реактивів, є ряд проб, за допомогою яких можна зробити висновок про відсутністьабо наявність тих чи інших аніонів. Отже, спочатку проводять попередні дослідження.
1. Випробування реакції досліджуваного розчину
а) якщо реакція досліджуваного розчину кисла, то в розчині немає CO32-, NO2-, SO32-, S2O32- аніонів.
б) якщо реакція розчину лужна, то виявляють аніони легких кислот. Для цього у пробірку вносять кілька крапель досліджуваного розчину і додають 0,5 мл 2 н. розчину сульфатної кислоти. Суміш перемішують та нагрівають. Виділення газу свідчить про наявність одного або кількох аніонів: CO32-, NO2-, SO32-, S2-, S2O32-.
2. Виявлення аніонів-окисників
а) якщо досліджуваний розчин безбарвний, то в ньому відсутні іони MnO4-, Cr2O72-, CrO42-, але можуть бути присутні NO2-, AsO43- аніони. Для їх виявлення у пробірку вміщують 0,25-0,5 мл досліджуваного розчину, підкислюють 2 н. розчином сульфатної кислоти, додають 2-3 краплі 1%-го розчину крохмалю та 0,25 мл розчину калій йодиду. Посиніння розчину свідчить про наявність аніонів-окисників.
3. Виявлення аніонів-відновників
До 0,25-0,5 мл досліджуваного розчину додають 2 н. розчин сульфатної кислоти до нейтральної реакції. Потім додають ще 0,5 мл надлишку та краплями 0,1 н. розчин калій перманганату. Знебарвлення розчину свідчить про наявність аніонів-відновників (S2-, SO32-, S2O32-, NO2-).
4. Виявлення аніонів першої аналітичної групи
До 0,25-0,5 мл нейтрального досліджуваного розчину додають 0,25-0,5 мл розчину барій хлориду. Утворення осаду свідчить про присутність аніонів першої аналітичної групи. В цьому випадку проводять характерні реакції на виявлення кожного аніону цієї групи.
5. Виявлення аніонів другої аналітичної групи
До 0,25-0,5 мл досліджуваного розчину додають кілька крапель нітратної кислоти і 0,25-0,5 мл розчину аргентум нітрату. Утворення осаду свідчить про присутність аніонів другої аналітичної групи. У цьому випадку проводять характерні реакції на виявлення кожного аніону цієї групи.
Література: [9] с.13-32, 71-450; [11]; [13]; [15]
ОРГАНІЧНІ АНАЛІТИЧНІ РЕАГЕНТИ
Лекція №14 (1 година)
План
1. Органічні реагенти.
2. Приклади органічних реагентів, що мають застосування в аналізі.
Органічні реагенти
Перші органічні реактиви були знайдені емпіричним шляхом. Потім вчені В.І.Кузнєцов, А.П.Терентьєв, Л.М.Кульберг, І.М.Коренман та інші вивчали залежність між будовою органічних речовин та їхньою взаємодією з іонами неорганічної природи та приступили до синтезу нових реактивів.
Під час пошуку нових специфічних органічних реактивів використовують сполуки з певними групами атомів: гідроксильною ¾OH, гідросульфідною ¾SH, оксимною ¾NOH, імінною ¾NH, карбоксильною ¾COOH, сульфогрупою ¾SO3H. Характер взаємодії неорганічних іонів з органічними реактивами залежить від положення відповідних елементів у періодичній системі, від електронних структур іонів та будови молекул органічних речовин.
Переваги застосування органічних реактивів полягають у тому, що вони є високо чутливими та дозволяють визначати дуже малі кількості іонів. Крім того, специфічність органічних реактивів часто дає можливість визначити окремі іони без попереднього розділення, що дуже важливо для практики. Органічні реактиви дуже різноманітні.
Приклади органічних реагентів, що мають застосування в аналізі
1. Алізарин (1,2-діоксиантрахінон) з іонами Al3+ утворює комплексну сполуку ярко-червоного кольору, яка не розчиняється в етановій кислоті. Ця сполука називається “алюмінієвим лаком”. Алізарин малорозчинний у воді, тому на практиці використовують алізариновий червоний ¾ натрієву сіль 1,2-діоксантрахінон-3 сульфокислоти.
C14H5O2(OH)2SO3Na+Al(OH)3=[Al(OH)C14H5O2(OH)2SO3Na]0
Іони Fe3+, Cu2+, Bi3+ заважають реакції, бо з алізарином вони теж утворюють забарвлені осади.
Реакцію виявлення Al3+ алізарином краще проводити в слабко кислому середовищі (pH=4,2....4,6), у цих умовах алізарин дає жовтий колір. У лужному середовищі фіолетовий колір самого алізарину маскує червоне забарвлення алюмінієвого комплексу і впливає на результати аналізу.
2. a-нітрозо-b-нафтол (реактив Ільїнського) окиснює кобальт(II) у кобальт(III), із яким утворює червоно-бурий осад внутрикомплексної солі (C10H6NOO)3Co. Осад не розчиняється у мінеральних кислотах.
Такі самі реакції у присутності реактиву Ільїнського відбуваються з іонами Fe3+, Cu2+, Hg2+, але осади цих іонів розчиняються в мінеральних кислотах.
3. Диметилгліоксим (реактив Чугаєва) в амоніачному середовищі утворює з іоном Ni2+ комплексну сполуку яскраво-червоного кольору ¾- диметилгліоксимат нікелю. Рівняння реакції має такий вигляд:
NiSO4+2C4H8N2O2+2NH4OH → Ni(C4H7N2O2)2+(NH4)2SO4+2H2O.
Нікель диметилгліоксимат не розчиняється у розведеному розчині амоніаку, але розчиняється в сильних кислотах та лугах.
Реакції Ni2+ з диметилгліоксимом заважають іони Fe3+, що утворюють із розчином амоніаку гідроксид, нерозчинний у воді, а також іони Fe2+, які з диметилгліоксимом утворюють комплексну сіль червоного кольору. Вплив іонів Fe3+ можна усунути маскуванням за допомогою фториду лужного металу, а вплив іонів Fe2+ ¾ окисненням в іони Fe3+ дигідроген пероксидом .
4. Натрій гідрогентартрат NaHC4H4O6 із розчинами солей калію утворює білий кристалічний осад:
KCl+NaHC4H4O6 → KHC4H4O6↓+NaCl.
Утворений осад ¾ кисла сіль винної кислоти. Сама винна кислота H2C4H4O6, її середні солі (K2C4H4O6, Na2C4H4O6, (NH4)2C4H4O6), подвійна сіль KNaC4H4O6, а також натрій гідрогентартрат NaHC4H4O6 добре розчинні у воді. Калій гідрогентартрат KHC4H4O6 і амоній гідрогентартрат NH4HC4H4O6 ¾ малорозчинні сполуки. Якщо подіяти сильною кислотою або лугом, то калій гідрогентартрат розчиниться. Реакції розчинення відбуваються за такими рівняннями:
KHC4H4O6↓+HCl → H2C2H4O6 +KCl,
KHC4H4O6↓+NaOH → KNaC4H4O6+H2O.
Слід пам'ятати, що калій гідрогентартрат розчиняється під час нагрівання розчину, реакція його утворення відбувається в концентрованих розчинах калій-іонів. Тому під час виявлення іонів K+ за допомогою натрій гідргентартрату треба додержуватись таких умов: а) реакцію проводити в слабокислому середовищі; б) концентрація калій-катіонів повинна бути достатньо великою; в) реакцію треба проводити за умови охолодження, у відсутності іонів NH4+.
5. Бензидин (С6Н5)2NH утворює з хром(VI)- та манган(IV)-іонами сполуки синього кольору.
Література: [3] т.1, с.164-177
ТЕОРІЯ ТА ПРАКТИКА ВІДБИРАННЯ ПРОБИ ТА ЇЇ ПІДГОТОВКА
Лекція №14 (1 година)
План
1. Об'єкти аналізу. Поняття про пробу. Відбирання проби.
2. Переведення проби у розчин.
3. Методи розкладання окисненням і відновленням.
4. Аналіз сумішей катіонів і аніонів (якісний хімічний аналіз речовини).
Об'єкти аналізу. Поняття про пробу. Відбирання проби
Хімічний аналіз найчастіше починають із відбору та підготовки проби до аналізу. Необхідно відмітити, що усі стадії аналізу зв’язані між собою. Так, ретельно виміряний аналітичний сигнал, не дає правильної інформації про вміст визначаємого компоненту, якщо неправильно проведений відбір чи підготовка проби до аналізу.
Порядок відбору проби і її підготовка наводяться у відповідних Державних стандартах.
Для проведення аналізу, як правило, беруть середню пробу. Це невелика частина досліджуваного об'єкту, середній склад та властивості якої повинні бути ідентичними в усіх відношеннях середньому складу та властивостям досліджуваного об'єкта. Розрізняють генеральну, лабораторну та досліджувану проби. Генеральна (груба) проба відбирається безпосередньо з досліджуваного об'єкта. Вона достатньо велика ¾ звичайно, 1-50 кг, для деяких об'єктів складає іноді 0,5-5 т.
Із генеральної проби шляхом її скорочення відбирають лабораторну пробу (звичайно, від 25 до 1 кг). Одну частину лабораторної проби використовують для попередніх досліджень, другу ¾ зберігають для можливих у майбутньому арбітражних аналізів, третю ¾ використовують безпосередньо для аналізу (досліджувана проба). Якщо необхідно, то пробу подрібнюють та усереднюють. Для досліджуваної проби проводять декілька визначень компонента: з окремих наважок 10-1000 мг (якщо досліджуваний об'єкт ¾ тверда речовина) чи аліквот (якщо досліджувана речовина ¾ рідина чи газ). Вміст визначаємого компоненту в досліджуваній пробі повинен відображати середній вміст цього компоненту в досліджуваному об'єкті, тобто досліджувана проба повинна бути представницькою.
Відбирання проби газів
Пробу газа відбирають, вимірюючи його об’єм за допомогою вакуумної мірної колби чи бюретки з відповідною запорною рідиною, часто конденсують газ у пастках різного типу за низьких температур.
Відбирання проби рідин
Способи відбирання гомогенних і гетерогенних рідин різні.
Пробу гомогенної рідини відбирають за допомогою відповідних піпеток, бюреток та мірних колб. Відбирання проби із загального об’єму проводять після ретельного перемішування. Відбір гомогенної рідини проводять через певні інтервали часу і в різних місцях. Для відбирання проб на різній глибині застосовують спеціальні пробовідбірні прилади ¾ барометри різної конструкції.
Проби гетерогенних рідин відбирають не тільки за об’ємом, але і за масою. Щоб відібрати пробу, рідину гомогенізують чи добиваються повного її розділення на окремі шари.
Таким чином, в залежності від природи рідини та задачі, яку вирішують, під час аналізу може змінюватись спосіб, час відбирання проби та її розмір.
Відбирання проби твердих речовин
Під час відбирання генеральної, лабораторної та досліджуваної проби твердих речовин виникає питання про розмір проби.
Оптимальна маса проби обумовлена неоднорідністю досліджуваного об’єкту, розміром частинок, з яких починається неоднорідність та вимогами до точності аналізу, які звичайно, визначають за похибкою у відбиранні проби.
Залежність маси представницької проби від розміру (діаметру, d) неоднорідних частинок проілюстрована нижче:
d, мм 40-50 25 10 5 3 2 1
Q, кг 50-3×103 10-700 2-100 0,5-25 0,2-10 0,1-5 0,02-1
Для розрахунку оптимальної маси представницької проби існує декілька прийомів. Часто використовують формулу Річердса-Чеччота:
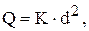
де Q - маса проби, яка забезпечує показність, кг;
d - найбільший діаметр неоднорідних частинок, мм;
К - емпіричний коефіцієнт пропорційності, що характеризує ступінь неоднорідності розподілу визначаємого компоненту в матеріалі, змінюється у межах 0,02 - 1.
Способи відбору генеральної проби твердої речовини різні для речовин, які знаходяться у вигляді цілого чи подрібненого продукту.
Після відбирання генеральної проби твердої речовини здійснюють процес гомогенізації, який включає операції подрібнення та просівання. Ці операції чередуюють до тих пір, доки не одержать достатньо розтерту однорідну пробу. Наступний етап відбирання проби ¾ усереднення, яке включає операції перемішування та скорочення проби. Перемішування може проводитись механічно, за методом конуса та кільця. Скорочення проби проводять різними способами. Цей процес, як правило, багатостадійний, включає повторне перемішування та розподіл.
Дата добавления: 2016-12-16; просмотров: 1743;
