Методи практичного визначення водневого показника
· За допомогою індикаторів.
Індикатори - реагенти, які змінюють свій колір у залежності від концентрації гідроген-іонів. Зміна кольору протікає в межах певного, характерного для даного індикатора інтервалу значень рН, який називається областю переходу індикатора.
Застосовують кислотно-основні (метилоранж, фенолфталеїн) та окисно-відновні індикатори.
· За допомогою фізико-хімічних методів (наприклад, потенціометричний метод визначення рН розчинів).
Буферні системи в аналітичній хімії
Буферний розчин - суміш слабкої кислоти (чи основи) з її сіллю, яка регулює концентрацію гідроген-іонів у розчині, зменшуючи вплив різних факторів, що змінюють рН розчину.
Здатність буферних розчинів підтримувати постійне рН базується на тому, що компоненти їх зв'язують гідроген- чи гідроксид-іони кислот чи основ, які вводять у розчин. Ця здатність не безмежна і залежить від концентрації компонентів буферної суміші.
Висновки:
· Будь-яка буферна суміш практично зберігає сталість рН лише до додавання деякої певної кількості кислоти чи лугу, тобто має певну буферну ємність.
Буферна ємність - максимальна кількість сильної кислоти чи лугу певної концентрації, яку можна додати до буферного розчину, щоб значення його рН змінилось не більше ніж на одиницю.
· Максимальна буферна ємність спостерігається в тих розчинах, які містять рівні концентрації слабкої кислоти та її солі, чи слабкої основи та її солі.
· Буферна ємність розчину тим більше, чим вище концентрація компонентів буферної суміші.
· Під час додавання до буферного розчину кислоти чи лугу стійкість розчину до зміни рН зменшується.
Таблиця 1
Найбільш уживані буферні суміші
| Назва суміші | Склад | рН |
| Форміатна | HCOOH+HCOONa | 3,8 |
| Бензоатна | C6H5COOH+C6H5COONa | 4,2 |
| Ацетатна | CH3COOH+CH3COONa | 4,8 |
| Фосфатна | NaH2PO4+Na2HPO4 | 6,6 |
| Амонійна | NH4OH+NH4Cl | 9,2 |
Концентрації компонентів однакові.
Література: [1] с.56-64, 65-79; [6] с.213-227, 243-248, 256-265; [9] с. 102-119
РІВНОВАГА У РОЗЧИНАХ СОЛЕЙ, ЯКІ ПІДДАЮТЬСЯ
ГІДРОЛІЗУ
Лекція №8 (2 години)
План
1. Амфоліти. Застосування амфотерності в аналітичній хімії.
2. Гідроліз солей.
3. Кількісні характеристики процесу гідролізу.
4. рН розчину солей, що піддаються гідролізу.
Амфоліти. Застосування амфотерності в аналітичній хімії
З точки зору теорії електролітичної дисоціації кислоти - це електроліти, які дисоціюють у розчинах з утворенням гідроген-іонів, а луги - електроліти, які дисоціюють у розчинах із відщепленням гідроксид-іонів. Гідроксиди можуть взаємодіяти з кислотами з утворенням солей. Існують гідроксиди, які здатні вступати у взаємодію й утворювати солі не тільки з кислотами, але і з гідроксидами. Наприклад,
Zn(OH)2+2HCl=ZnCl2+2H2O,
Zn(OH)2+2NaOH=Na2ZnO2+2H2O.
Такі гідроксиди називають амфотерними електролітами. До них відносяться Al(OH)3, Zn(OH)2, Cr(OH)3, Pb(OH)2, Sn(OH)2, As(OH)3 та інші.
Явище амфотерності можна пояснити тим, що в молекулах амфолітів міцність зв’язку між металом та киснем не сильно відрізняється від міцності зв’язку між киснем та воднем. Дисоціація таких молекул можлива за місцями обох цих зв’язків. Якщо позначити амфоліт ROH, то дисоціацію можна виразити схемою:
Н++RO-ÛROHÛR++OH-.
Таким чином у розчині амфоліту існує складна рівновага, в якій приймають участь продукти дисоціації як за типом кислоти, так і за типом основи. Наприклад,
Zn(OH)2¯
ß
2H++ZnO22-ÛZn(OH)2ÛZn2++2OH-
Гідроліз солей
Гідроліз солей - взаємодія речовин із водою при якій складові частини речовини з’єднуються зі складовими частинами води.
Існує чотири випадки гідролізу:
Гідроліз за катіоном,якому підлягають солі утворені сильною кислотою і слабким лугом
NH4Cl+ H2O ®NH4OH+HCl,
NH4++ H2O ®NH4OH+H+ pH<7
У випадку двохзарядного катіону гідроліз іде за ступенями.
MgI2+ H2O ®MgOHI+HI,
Mg2++ H2O ®MgOH++H+. pH<7
Гідроліз за аніоном,якому підлягають солі утворені із сильного лугу та слабкої кислоти
NaNO2+H2O ®NaOH+HNO2,
NO2-+ H2O® HNO2+OH- pH>7
У випадку двохзарядного аніону гідроліз іде за ступенями.
Na2S+ H2O ®NaHS+NaOH,
S2-+ H2O ®HS-+OH-. pH>7
Гідроліз за катіоном та аніоном,якому підлягають солі утворені слабкою кислотою і слабким лугом
CH3COONH4+ H2O ®CH3COOH+NH4OH.
Щоб з’ясувати середовище, треба з’ясувати Кд(CH3COOH) і Кд(NH4OH).
Кд(CH3COOH) = Кд(NH4OH). Це означає, що в цьому випадку рН=7.
Якщо сіль утворена із сильних кислоти та лугу, то гідроліз не іде, тільки дисоціація електроліту
NaOH+HCl®NaCl+H2O,
NaCl+H2O®Na++Cl-+H++OH-. рН=7
Кількісні характеристики процесу гідролізу
Кількісно процес гідролізу характеризується ступенем гідролізу (α) та константою гідролізу (Кгідр).
Ступінь гідролізу, тобто мольна доля електроліту, яка піддається гідролізу (у %), залежить від природи солі, температури та концентрації розчину. Розведення розчину та нагрівання збільшують ступінь гідролізу.
Константою гідролізу називають перетворену константу рівноваги реакції гідролізу. Наприклад, для реакції гідролізу етаноат-іона:
CH3COO-+ H2O ®CH3COOH+OH-.
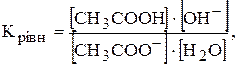
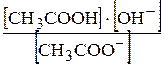 .
.
Для малодисоційованих розчинів [Н2О] 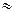 const, тому Крівн×[Н2О]=const=Кгідр. Шляхом перетворень можна виразити Кгідр через величини константи дисоціації слабкої кислоти, яка утворюється в результаті гідролізу (Ккисл) та іонного добутку води.
const, тому Крівн×[Н2О]=const=Кгідр. Шляхом перетворень можна виразити Кгідр через величини константи дисоціації слабкої кислоти, яка утворюється в результаті гідролізу (Ккисл) та іонного добутку води.
Замінивши через іонний добуток води (Кw) концентрацію гідроксид-іонів
[ОН-]= 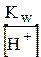 , отримують вираз Кгідр. для випадку гідролізу за аніоном:
, отримують вираз Кгідр. для випадку гідролізу за аніоном:
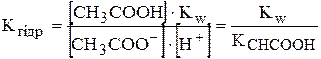 ;
; 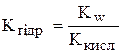 .
.
Аналогічно за катіоном: 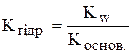 .
.
рН розчину солей, що піддаються гідролізу
Сіль утворена із сильної кислоти та слабкої основи
NH4OH+HCl=NH4Cl+H2O
NH4++H2O=NH4OH+H+. Середовище кисле.
Чим слабкіше основа, тим більше рівновага зміщується праворуч, тобто концентрація гідроген-іонів у розчині визначається здатністю до дисоціації слабкої основи, тобто значенням її константи дисоціації:
Косн.= 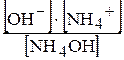 . Кw=[Н+]×[ОН-
. Кw=[Н+]×[ОН-  ]
]
Кгідр= 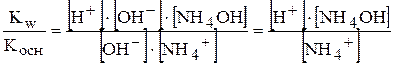 .
.
З рівняння гідролізу видно, що з кожної молекули NH4OH утворюється один гідроген-катіон. Це означає, що рівноважна концентрація гідроген-іонів дорівнює рівноважній концентрації розчину амоніаку. Рівноважну концентрацію амоній-катіонів можна прийняти рівною початковій концентрації солі (Ссолі), тому сіль майже повністю дисоціює.
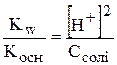 ,
, 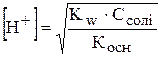 ,
,
lg 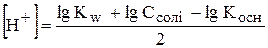 ,
,
-lg 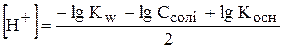 ,
,
рН= 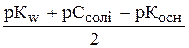 .
.
Сіль утворена із слабкої кислоти та сильної основи
CH3COOH+NaOH=CH3COONa+H2O,
CH3COO-+H2O=CH3COOH+OH-.
Константа дисоціації етанової кислоти записується таким чином:
Ккисл= 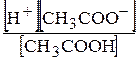 .
.
Підставимо вираз константи дисоціації кислоти у рівняння константи гідролізу:
Кгідр= 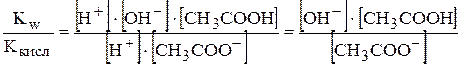 ,
,
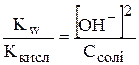 .
.
Виразимо концентрацію гідроксид-іонів з іонного добутку води:
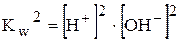 ,
, 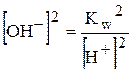 .
.
Підставимо у рівняння 1 рівняння 2:
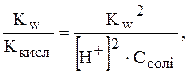

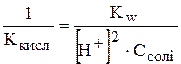 .
.
Виразимо концентрацію гідроген-іонів:
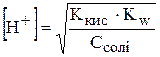 .
.
Прологарифмуємо одержане рівняння:
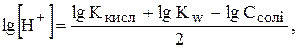
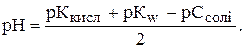
Сіль утворена зі слабкої кислоти та слабкої основи основи
CH3COOH+NН4OH=CH3COONН4+H2O.
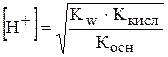 .
.
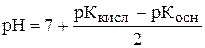 .
.
Література: [2], с. 200-206; [6], с.283-288; [9], с.228-235
РІВНОВАГА У РОЗЧИНАХ МАЛОРОЗЧИННИХ СПОЛУК
Лекція №9 (2 години)
План
1. Теоретичні умови осадження малорозчинних сполук.
2. Умови утворення осадів.
3. Фактори, що впливають на розчинність осадів.
4. Використання осадження для розділення та визначення різних сполук.
Теоретичні умови осадження малорозчинних сполук
Під час аналізу використовують не тільки гомогенні, але й гетерогенні системи. Наприклад, система, яка складається з насиченого розчину, що торкається з осадом відповідної речовини. Окремі частини гетерогенної системи, які розділені поверхнями розподілу, називаються її фазами. Таким чином, осад та насичений розчин ¾ це різні фази гетерогенної системи. Під час виконання аналітичних операцій, таких як, осадження чи відділення іонів, промивання та розчинення осадів, мають справу з гетерогенними системами.
Розглянемо малорозчинний електролыт під час його зіткнення з водою. Кристалічна градка барій сульфату утворена барій(ІІ)-катіонами та сульфат-аніонами, які у процесі розчинення під дією диполей води переходять з поверхні кристалів у розчин. Одночасно з процесом розчинення почнеться і зворотній процес ¾ осадження барій сульфату. Поступово швидкість процесу розчинення речовини зменщується, а швидкість протилежного процесу ¾ осадження ¾ збільшується , що призводить до стану динамічної рівноваги. До насиченого розчину, як до рівноважної системи, застосуємо закон діючих мас. Якщо швидкість процесу розчинення  показує кількість барій(ІІ)-катіонів та сульфат-аніонів, що уходять за певний час з поверхні твердої фази у розчин, то швидкість повинна бути прямопропорційна числу цих іонів на одиниці поверхні. Однак, при зменшенні загальної кількості твердої фази розташування іонів на її поверхні залишається незмінним. Тому можна припустити, що швидкість розчинення твердої фази залишається постійною і дорівнює величині k1
показує кількість барій(ІІ)-катіонів та сульфат-аніонів, що уходять за певний час з поверхні твердої фази у розчин, то швидкість повинна бути прямопропорційна числу цих іонів на одиниці поверхні. Однак, при зменшенні загальної кількості твердої фази розташування іонів на її поверхні залишається незмінним. Тому можна припустити, що швидкість розчинення твердої фази залишається постійною і дорівнює величині k1
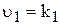 .
.
Швидкість протилежного процесу ¾ осадження ¾ 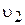 визначається числом зіткнень барій(ІІ)-катіонів та сульфат-аніонів з одиницею поверхні кристалів барій сульфату за той самий час.
визначається числом зіткнень барій(ІІ)-катіонів та сульфат-аніонів з одиницею поверхні кристалів барій сульфату за той самий час.
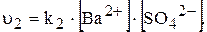
У насиченому розчині швидкості обох процесів однакові:
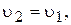
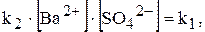
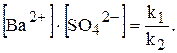
Відношення двох постійних величин 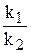 є величина постійна, яку позначають через ДР(BaSO4):
є величина постійна, яку позначають через ДР(BaSO4): 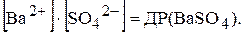
Величина ДР кількісно характеризує властивість електроліту розчинятись і називається добутком розчинності. Як би не змінювались концентрації окремих іонів у насиченому розчині малорозчинного електроліту, добуток їх (за умови сталості температури) залишається постійною величиною.
У загальному випадку малорозчинний електроліт дисоціює за рівнянням:
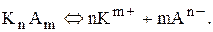
Правило добутку розчинності одержує такий матиматичний вираз:
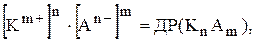
де 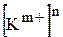 та
та 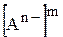 ¾ рівноважні концентрації катіонів та аніонів, що утворюються підчас дисоціації електроліту
¾ рівноважні концентрації катіонів та аніонів, що утворюються підчас дисоціації електроліту 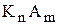 ;
;
n, m ¾ степені, у які необхідно звести концентрації іонів.
Для більш точного розрахунку добутків розчинності слід використовувати не тільки концентарції іонів малорозчинної сполуки, а також їх активності, тому що у розчині електроліту діють міжіонні сили. Якщо враховувати ці сили, то вираз для добутку концентрації барій сульфату буде мати вигляд:
ДР(BaSO4)=a(Ba2+)a(SO42-) чи ДР(BaSO4)=[Ba2+]×[SO42-]×f (Ba2+)f(SO42-),
де a(Ba2+) та а(SO42-) ¾ активності барій(ІІ)-катіонів та сульфат-аніонів,
f (Ba2+) та f(SO42-) ¾ коефіцієнти активності цих іонів.
Умови утворення осадів
Вплив концентрації іонів
Осад малорозчинної сполуки утворюється тільки тоді, коли добуток концентрацій іонів стане більшим за величину її добутку розчинності (за умов певної температури).
Вплив кількості осаджувача
Для практично повного осадження іону у вигляді сполуки, яка помітно розчиняється у воді, необхідно діяти найлишком осаджуючого реактиву. Встановлено, що при цьому краще брати 1,5 надлишок осаджувача.
Вплив комплексоутворення
Збільшення розчинності осадів під час додавання великого надлишку осаджувача може бути обумовлено амфотерністю сполук, що утворюються чи утворенням кислих солей. Крім того, надлишок осаджувача визиває сольовий ефект і розчинність осадів збільшується.
Вплив розчинності осаджуваної сполуки
В однакових умовах осадження іонів бути тим повніше, чим менш розчинним є сполука, у вигляді якої осаджують даний іон.
Вплив дисоціації осаджувача
Важливе значення має ступінь дисоціації осаджувача, тому що ним визначається концентрація іона-осаджувача у розчині.
На повноту осадження може також впливати гідроліз осаджувача. Гідроліз групових реагентів запобігає повному осадженню катіонів.
Вплив рН розчину
Повне осадження кожної речовини відбувається у певній області концентарції гідроген-іонів. Регулюють рН розчину додаванням кислот, лугів чи буферних сумішей. При цьому луг чи кислоту вибирають таким чином, щоб вони не заважали подальшому відкриттю іонів.
Особливо зручні для регулювання рН раствора буферні суміші. Однак кожна з них має певну буферну ємність, тобто може зв’язувати певну кількість гідроген-іонів та гідроксид-іонів. Тому сильнокислі чи сильнодужні розчини попередньо нейтралізують лугом чи кислотою, після чого застосовують буферну суміш. Інакше її дія не буде ефективною.
Фактори, що впливають на розчинність осадів
Вплив дисоціації сполук
Для розчинення якого-небудь осаду необхідно звязувати один з іонів, що переходять у розчин, таким іншим іоном, який би утворював з ним сполуку, що малодисоціює.
Вплив кислотності
Малорозчинні солі слабких кислот розчиняються у сильних кислотах, тому що при цьому гідроген-іони зв’язують аніони солей у малодисоційовані молекули слабких кислот.
Кислі солі деяких слабких кислот розчиняються не тільки в сильних кислотах, але й у лугах.
Вплив комплексоутворення
Деякі осади солей розчиняються з утворенням міцних комплексних іонів. Наприклад, аргентум хлорид легко розчиняється у розчині амоніаку, тому що аргентум-катіони зв’язуються з молекулами амоніаку у комплексі катіони:
AgCl+2NH3®[Ag(NH3)2]Cl.
Використання осадження для розділення та визначення різних сполук
1. Реакції осадження використовують у ході систематичного аналізу суміші катіонів шести аналітичних груп для відділення однієї групи від іншої. Наприклад, для відділення катіонів першої анаіличної групи застосовують реакцію взаємодії аргентум(І)-, плюмбум(ІІ)-, меркурі(І)-катіонів з хлоридною кислотою:
AgNO3+HCl®AgCl¯+HNO3,
PbNO3+2HCl®PbCl2¯+2HNO3,
Hg2(NO3)2+2HCl®Hg2Cl2¯+2HNO3.
Розведена сульфатна кислота може бути груповим реактивом на катіони другої аналітичної групи: іон SO42- утворює з катіонами Ba2+, Sr2+, Ca2+ білі осади:
BaCl2+Na2SO4®BaSO4¯+NaCl,
CaCl2+Na2SO4®CaSO4¯+2NaCl,
SrCl2+Na2SO4®SrSO4¯+2NaCl.
2. Реакції осадження широко використовуються для визначення окремих іонів.
Наприклад, їдкі луги KOH, NaOH і амоніак NH3 утворюють з Fe(III)-катіоном червоно-бурий осад ферум(III) гідроксиду:
FeCl3+3NaOH®Fe(OH)3¯+3NaCl.
Дигідроген сульфід, динатрій сульфід утворюють з купрум(2+)- іонами чорний осад купрум(II) сульфіду, який не розчиняється у розведених хлоридній та сульфатній кислотах, але розчиняється за умови нагрівання в 2 н. розчині нітратної кислоти:
CuSO4+Na2S→CuS↓+(NH4)2SO4,
3CuS↓+8HNO3→3Cu(NO3)2+3S+4H2O+2NO.
Аргентум нітратутворює з іодид-іономжовтий осад аргентум іодиду, який не розчиняється в нітратній кислоті і в розчині амоніаку (цим він відрізняється від хлоридів і бромідів, а розчиняється в динатрій триоксотіосульфаті і калій ціаніді:
KI+AgNO3®AgI↓+KNO3.
Література: [3] т.1, с.192-203; [6] с.219-288
РІВНОВАГА У РОЗЧИНАХ КООРДИНАЦІЙНИХ
(КОМПЛЕКСНИХ) СПОЛУК
Лекція №10 (2 години)
План
1. Загальна характеристика комплексних сполук.
2. Класифікація та номенклатура комплексних сполук.
3. Дисоціація та стійкість комплексів у розчинах.
4. Застосування комплексних сполук у хімічному аналізі.
Дата добавления: 2016-12-16; просмотров: 1647;
