II правило Клечковського
Якщо значення суми (n+L) однакові, заповнення перебігає послідовно у напрямку збільшення значення головного квантового числа n.
Правило Хунда
Стійкому стану атома відповідає таке розташування електронів у межах енергетичного підрівня, при якому абсолютне значення сумарного спіна атома максимальне.
Валентність, енергія іонізації й спорідненість до електрону, електронегативність
Валентість - здатність атомів хімічних елементів утворювати хімічні зв’язки з атомами інших елементів. З точки зору електронної будови атомів валентність - здатність атомів чи атомних угруповань віддавати чи приєднувати в кожному окремому випадку певну кількість електронів з утворенням еквівалентної кількості зв’язків.
Енергія іонізації - енергія, яку необхідно витратити для відриву електрона від атома з перетворенням останнього в позитивний іон.
Спорідненість до електрона - енергія, яка виділяється під час приєднання електрона до вільного атома.
Електронегативність - умовна величина, яка характеризує здатність атома в молекулі притягувати до себе електрони.
Теорія хімічної будови О.М. Бутлерова
Основні положення:
1. Атоми в молекулах з'єднані один з одним у певній послідовності. Зміна послідовності веде до утворення нової речовини з новими властивостями.
2. З’єднання атомів проходить відповідно з їх валентністю.
3. Властивості речовин залежать не тільки від складу, але й від їх “хімічної будови”, тобто від порядку з’єднання атомів у молекулах та характеру їх взаємного впливу. Найбільш сильно впливають друг на друга атоми, безпосередньо зв’язані між собою.
З теорії Бутлерова витікає можливість відображати будову молекул у вигляді структурних формул.
Механізм утворення хімічного зв’язку можна пояснити за допомогою метода валентних зв’язків. Цей метод базується на таких положеннях:
· Ковалентний зв’язок утворюється двома електронами з протилежно спрямованими спінами, при чому ця електронна пара належить двом атомам.
·Ковалентний зв’язок тим міцніше, чим у більшому ступені перетинаються електронні хмари, що взаємодіють.
Комбінації таких зв’язків одержали назву валентних схем.
Параметри хімічного зв’язку
Насиченість - здатність атомів приймати участь в утворенні певного числа ковалентних зв’язків. Утворення ковалентного зв’язку – результат перекривання валентних електронних хмар атомів, що взаємодіють. Але таке перекривання можливе тільки під час певної взаємної орієнтації електронних хмар, тобто ковалентний зв’язок має напрямленість (s-зв’язок, p-зв’язок).
Гібридизація атомних орбіталей і просторова конфігурація молекул. s-, p- зв’язки
Згідно з методом гібридизації електронних орбіталей під час утворення молекули замість вихідних атомних s-, p-, d-, f-електронних хмар утворюються такі рівноцінні “змішані” чи гибридні електронні хмари, які витягнуті в напрямку до сусідніх атомів, завдяки чому досягається їх більш повне перекривання з електронними хмарами цих атомів. Існують чотири випадки гібридізації: sp - гібридизація, sp2 - гібридизація, sp3 - гібридизація, sp3d2 - гібридизація.
Типи ковалентного зв’язку
а) неполярний зв’язок - якщо двохатомна молекула складається з одного елемента (H2, N2, Cl2) і кожна електронна хмара, яка утворюється загальною парою електронів, розташовується у просторі симетрично відносно ядер обох атомів.
б) полярний ковалентний зв’язок - якщо молекула складається з атомів різних елементів і загальна електронна хмара зміщена у бік одного з атомів, так що виникає асиметрія в розташуванні заряду.
Для оцінки здатності атома даного елемента відтягувати до себе загальну електронну пару користуються величиною відносної електронегативності. Чим більше електронегативність атома, тим сильніше притягує він загальну електронну пару. Зміщення загальної електронної хмари під час утворення полярного ковалентного зв’язку приводить до того, що середня густина негативного електричного заряду стає вище поблизу більш електронегативного атома та нижче поблизу менш електронегативного. В результаті перший атом має надлишковий негативний, а другий - надлишковий позитивний заряди. Ці заряди називають ефективними зарядами атомів у молекулі. Такі молекули можна розглядати, як системи з двох рівних за абсолютними величинами, але протилежними за знаками зарядів, які розташовані на певній відстані друг від друга. Такі системи називають електричними диполями.
Хоча сумарний заряд диполя дорівнює нулю, у навколишньому просторі утворюється електричне поле. Напруженість цього поля пропорційна дипольному моменту молекули m, який є добутком абсолютного значення заряду електрона q на відстань l між центрами зарядів у молекулі:
m=q×l
Дипольний момент - кількісна характеристика полярності молекули. Вимірюється в дебаях (Д):
1Д=3,33×10-30 Кл×м.
Способи утворення ковалентного зв’язку
1. За рахунок неспарованих електронів, які є в невзбуджених взаємодіючих атомах.
2. За рахунок неспарованих електронів, які з’являються, коли атом переходить у збуджений стан.
3. За рахунок спарених електронів, які є в зовнішньому електронному шарі. У цьому випадку ковалентний зв’язок утворюється за рахунок пари електронів, яка була у одного атома (донора електронної пари), та вільної орбіталі іншого атома (акцептора електронної пари). Такий спосіб утворення ковалентного зв’язку називається донорно-акцепторним.
Водневий зв'язок
Атом водню може утворювати зв’язок із подібним атомом. Цей зв’язок називають водневим. Умовою утворення водневого зв’язку є висока електронегативність атома, який безпосередньо зв’язаний у молекулі з атомом водню. Тому наявність водневого зв’язка характерна для сполук найелектронегативних елементів і сильніше всього вона проявляється у сполук флуору та кисню, слабкіше - у сполук нітрогену, ще слабкіше - у сполук хлору та сірки.
Іонний зв’язок
Зв’язок такого типу здійснюється внаслідок взаємного електростатичного притяжіння протилежно заряджених іонів. Іони можуть бути простими, тобто складатися з одного атома (наприклад, катіони Na+, K+, аніони F-, Cl-) чи складними, тобто складатися з двох чи більше атомів (наприклад, катіон NH4+, аніони OH-, NO3-, SO42-).
На відміну від ковалентного зв'язку іонний зв’язок не має напрямленості. Це пояснюється тим, що його електричне поле має сферичну симетрію, тобто зменшується з відстанню за одним законом у будь-якому напрямку. Тому взаємодія між іонами здійснюється однаково незалежно від напрямку.
Два різнойменних іони, що притягуються один до одного, зберігають здатність електростатично взаємодіяти з іншими іонами. У цьому полягає ще одна різниця між іонним та ковалентним типами зв’язку: іонний зв’язок не має насиченості. Відсутність в іонного зв’язку напрямленості та насиченості обумовлює схильність іонних молекул до асоціації, тобто до їх з’єднання.
Металевий зв’язок
Металевий зв’язок - тип хімічного зв’язку, який спостерігається між частинками, що утворюють метали. Він визначається одночасною наявністю звичайних ковалентних зв’язків між іонами та вільними електронами. Таким чином, металевий зв’язок є властивістю не окремих часток, а їх агрегатів.
Література: [1] с.23-26, 39-47; [2] с.70-96]; [6] с.108-117, 119-134
ШВИДКІСТЬ ТА МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ
Лекція №5 (2 години)
План
1. Швидкість та механізм хімічних реакцій. Вплив різних факторів на швидкість реакції. ЗДМ.
2. Хімічна рівновага.
3. Елементи теорії каталізу.
Швидкість та механізм хімічних реакцій. Вплив різних факторів на швидкість реакції. ЗДМ
Швидкість хімічної реакції визначається зміною концентрації однієї з реагуючих речовин за одиницю часу за незмінному об’єму системи.
Якщо в момент часу 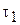 концентрація реагуючої речовини відповідала
концентрація реагуючої речовини відповідала 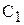 моль/л, а в наступний момент часу
моль/л, а в наступний момент часу 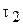 виявилася відповідною
виявилася відповідною 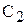 моль/л, то співвідношення
моль/л, то співвідношення
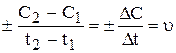
виражає середню швидкість реакції 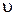 за проміжок часу:
за проміжок часу:
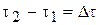 (с).
(с).
Чим менше проміжок часу 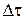 і відповідний йому спад концентрації
і відповідний йому спад концентрації 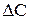 , тим ближче відношення
, тим ближче відношення 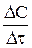 до дійсної швидкості реакції у відповідний момент часу
до дійсної швидкості реакції у відповідний момент часу 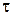 .
.
Швидкість кожної реакції залежить від природи реагуючих речовин, від їх концентрації та від умов, в яких реакція перебігає (температура, тиск, присутність каталізаторів).
Дуже важливе положення було встановлено в 1867 р. двома вченими Гульдбергом і Вааге та одержало назву закон діючих мас (ЗДМ): швидкість хімічної реакції за сталої температури пропорційна добутку концентрацій реагуючих речовин, зведених у степені їхніх стехіометричних коефіцієнтів.
Так, для гомогенної реакції типу:
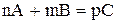
швидкість становить:
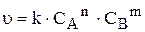 ,
,
де k — константа швидкості,
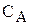 і
і 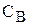 — концентрації реагуючих речовин у певний момент часу.
— концентрації реагуючих речовин у певний момент часу.
У гетерогенних реакціях концентрації речовин, що перебувають у твердому стані, практично не змінюються протягом реакції і тому не включаються в рівняння закону діючих мас. Наприклад, для реакції:
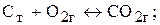
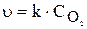 чи
чи 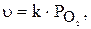
де 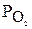 — парціальний тиск кисню.
— парціальний тиск кисню.
Залежність швидкості реакції (або константи швидкості реакції) від температури визначається правилом Вант-Гоффа: із підвищенням температури на кожні 10 С швидкість більшості реакцій зростає в 2‑4 рази.
Ця залежність виражається співвідношенням:
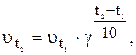
де 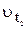 ‑ швидкість реакції після підвищення температури до
‑ швидкість реакції після підвищення температури до 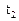 ;
;
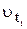 ‑ початкова швидкість реакції за температури
‑ початкова швидкість реакції за температури 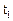 ;
;
g ‑ температурний коефіцієнт швидкості реакції, який показує, у скільки збільшується швидкість реакції із підвищенням температури реагуючих речовин на 10 градусів.
Правило Вант-Гоффа приблизне й застосовується лише для орієнтовної оцінки впливу температури на швидкість реакцій. Точніше залежність константи швидкості від температури виражається рівнянням Арреніуса:
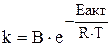 ,
,
де B ‑ коефіцієнт пропорційності;
Еакт ‑ енергія активації, кДж;
R ‑ газова постійна (8,31 кДж/(моль×К));
Т = (t+273°) ‑ абсолютна температура, К.
Чим нижче енергія активації Еакт і вище температура, тим більше константа швидкості.
Хімічна рівновага
Хімічні реакції можна поділити на оборотні і необоротні.
Реакції, які відбуваються в одному напрямку і завершуються повним перетворенням вихідних реагуючих речовин у кінцеві речовини, називаються необоротними. Прикладом такої реакції може бути розклад калій хлорату (бертолетової солі) під час нагрівання:
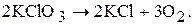
Реакція припиниться тоді, коли весь калій хлорат перетвориться на калій хлорид і кисень. Необоротних реакцій не так багато. Більшість реакцій оборотні. Оборотними називаються такі реакції, які одночасно відбуваються у двох взаємно протилежних напрямках.
Ці реакції не доходять до кінця внаслідок того, що продукти реакції взаємодіють між собою, утворюючи знову вихідні речовини. Оборотні реакції завершуються встановленням хімічної рівноваги.
Хімічна рівновага — це такий стан системи, коли швидкість прямої реакції дорівнює швидкості зворотної реакції.
У стані рівноваги пряма і зворотна реакції не припиняються. Тому така рівновага називається рухомою, або динамічною, рівновагою. А оскільки дія обох реакцій взаємно знищується, то в реагуючій суміші видимих змін не відбувається: концентрації всіх реагуючих речовин — як вихідних, так і тих, що утворюються, — залишаються чітко сталими. Концентрації реагуючих речовин, які встановлюються в умовах хімічної рівноваги, називаються рівноважними.
За певних умов реакції перебігають в одному напрямку до повного зникнення вихідних речовин. Такі реакції є практично необоротними. До них відносяться реакції, що супроводжуються виділенням:
продуктів, які виходять зі сфери реакції у вигляді осаду, газу;
малодисоційованих сполук;
великої кількості енергії.
У випадку оборотної хімічної реакції:
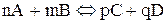
швидкість прямої та зворотної реакцій за законом діючих мас виражається відповідно рівняннями:
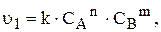
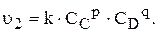
Оскільки з часом концентрація 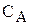 і
і 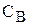 зменшується, а
зменшується, а 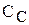 і
і 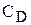 збільшується, швидкість прямої реакції
збільшується, швидкість прямої реакції 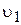 зменшується, а зворотної
зменшується, а зворотної 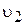 — збільшується.
— збільшується.
Із встановленням хімічної рівноваги швидкості прямої і зворотної реакції стають однаковими 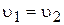 . Концентрації речовин А, B, С і D у момент рівноваги називаються рівноважними концентраціями. Їх позначають символами [A], [B], [C] і [D]. У зв’язку з цим умови рівноваги
. Концентрації речовин А, B, С і D у момент рівноваги називаються рівноважними концентраціями. Їх позначають символами [A], [B], [C] і [D]. У зв’язку з цим умови рівноваги 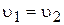 можна виразити наступною рівністю:
можна виразити наступною рівністю:
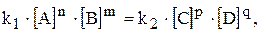
звідки: 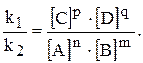
Тому що 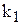 і
і 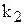 для даної температури постійні, то і їх відношення
для даної температури постійні, то і їх відношення 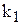 /
/ 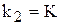 — постійне для тієї ж температури. Величина К називається константою хімічної рівноваги.
— постійне для тієї ж температури. Величина К називається константою хімічної рівноваги.
Рівняння (4.6), що зв’язує швидкість реакції із концентрацією реагуючих речовин, називається кінетичним рівнянням реакції (іншими словами — є вираженням закону діючих мас):
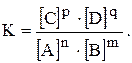
Величина К — найважливіша характеристика оборотної реакції. Константа рівноваги визначається природою реагуючих речовин і не залежить від їх концентрації, але змінюється під впливом температури і тиску (для газуватих речовин).
Константа рівноваги К показує, у скільки разів константа швидкості прямої реакції більше константи швидкості зворотної реакції. У цьому її фізичний смисл. Хімічна рівновага зберігається тільки за сталих умов. Зі зміною концентрацій реагуючих речовин, температури і тиску (для газових реакцій) рівновага порушується, рівноважні концентрації всіх речовин змінюються і встановлюється новий стан рівноваги.
Напрямок зміщення рівноваги визначається принципом рухомої рівноваги Ле Шательє: якщо на систему, що перебуває в стані рівноваги, чиниться будь-який зовнішній вплив (змінюється концентрація, температура, тиск), то він сприяє перебігу тієї із двох протилежних реакцій, яка послаблює цей вплив
Елементи теорії каталізу
Вплив різних сторонніх речовин на швидкість хімічних реакцій був відмічений вченими ще на початку дев’ятнадцятого сторіччя (К.С.Кірхгофф). У 1835 р. Берцеліус запропонував для таких речовин назву “каталізатори”, яка зберіглася до теперішніх часів.
Каталізатор ¾ це така речовина, яка змінює швидкість хімічного процесу, а склад і кількість її до кінця реакції залишаються без зміни. Дія каталізатора зводиться до зменшення енергії активації Еакт.
Явище зміни швидкості хімічної реакції у присутності каталізатора називається каталізом.
Розрізняють каталіз гомогенний і гетерогенний, у залежності від того, чи знаходиться каталізатор і реагуючі речовини в одній або різних фазах. У гетерогенному каталізі є межа розподілу фаз.
Якщо каталізатор перебуває в колоїдному стані, маємо справу з мікрогетерогенним каталізом. До цього роду каталізу відносяться біокаталітичні процеси, що відбуваються в живих організмах із величезною швидкістю й обумовлені наявністю в клітинах спеціальних каталізаторів-ферментів або ензимів.
Поряд із речовинами, що прискорюють реакцію, застосовують також речовини, які її сповільнюють. Такі речовини називають інгібіторами. Вони використовуються в техніці в ролі сповільнювачів процесів окиснення, корозії, як антидетонатори тощо.
Речовини, які навіть у малих кількостях знижують активність каталізаторів чи зовсім зупиняють його дію, називають каталітичними отрутами. Як і сам каталізатор, ці так звані каталітичні отрути діють специфічно: отруюють один каталізатор і не зашкоджують іншим. Причиною отруєння мабуть являється адсорбція поверхнею каталізатора каталітичних отрут, внаслідок чого останні оточують каталізатор і заважають підходу до нього молекул реагуючих речовин.
Якщо деякі речовини визивають отруєння каталізаторів, то інші, навпаки, під час додавання до каталізатору у невеликій кількості, сильно збільшують його активність, хоча самі не являються каталізаторами для цієї реакції. Такі речовини називаються промоторами.
Література: [2] с.184-197; [6] с.180-194
РОЗЧИНИ ТА ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
Лекція №6,7 (4 години)
План
1. Характеристика розчинів.
2. Способи визначення вмісту речовини у розчині.
3. Гідрати, кристалогідрати.
4.Теорія електролітичної дисоціації.
5.Стан сильних електролітів у розчині. Активність. Коефіцієнт активності.
6. Дисоціація кислот, основ і солей. Зміщення рівноваги.
7. Аналітичні реакції у розчинах електролітів як реакції іонів.
8. Дисоціація води.
9. Буферні системи в аналітичній хімії.
Характеристика розчинів
Розчин - тверда чи рідка гомогенна система, яка складається з двох чи більше компонентів (складових частин), відносні кількості яких можуть змінюватись в широких межах. Найбільш важливий вид розчинів-рідкі розчини.
Будь який розчин складається з розчинених речовин та розчинника. Розчинником вважають той компонент, який у чистому вигляді існує в такому ж агрегатному стані, що і розчин (наприклад, у випадку водного розчину солі, розчинником є вода). Якщо обидва компоненти до розчинення знаходились в однаковому агрегатному стані (наприклад, спирт і вода), то розчинником вважається той компонент, який знаходиться в більшій кількості.
Розчин, який знаходиться в рівновазі з речовиною, що розчинюється , називається насиченим розчином. У більшості випадків користуються ненасиченими розчинами. При цьому розчини з низьким вмістом розчиненої речовини називають розбавленими, а з високим - концентрованими.
Способи визначення вмісту речовини у розчині
Молярна концентрація (молярність) (С) - відношення кількості речовини до об’єму розчину. Одиниці вимірювання - моль/л.
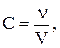
де 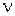 - кількість речовини, моль;
- кількість речовини, моль;
V - об’єм розчину, л.
Так як кількість речовини дорівнює відношенню маси речовини до її молекулярної маси, то вираз для розрахунку молярної концентрації можна записати у вигляді:
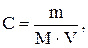
де 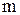 - маса речовини, г;
- маса речовини, г;
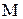 - молекулярна маса, г/моль;
- молекулярна маса, г/моль;
V - об’єм розчину, л.
Молярна концентрація еквівалента (нормальна концентрація, нормальність) (Сн, N)- відношення кількості моль еквівалентів розчиненої речовини до об’єму розчину. Одиниці вимірювання - моль/л.
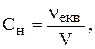
де 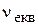 - кількість моль еквівалентів речовини, моль;
- кількість моль еквівалентів речовини, моль;
V - об’єм розчину, л.
Оскільки кількість моль еквівалентів дорівнює відношенню маси речовини до її еквівалента, то вираз для розрахунку молярної концентрації еквівалента можна записати у вигляді:
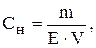
де 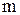 - маса речовини, г;
- маса речовини, г;
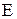 - еквівалент речовини, моль;
- еквівалент речовини, моль;
V - об’єм розчину, л.
Масова частка (W) - відношення маси розчиненої речовини до маси усього розчину. Вимірюється в долях одиниці чи у відсотках.
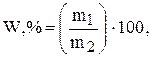
де 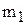 - маса розчиненої речовини, г;
- маса розчиненої речовини, г;
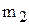 - маса розчину, г.
- маса розчину, г.
Мольна частка (N) - відношення кількості молів певного компонента до загальної кількості молів (безрозмірна величина).
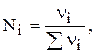
де 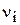 - кількість певного компонента, моль;
- кількість певного компонента, моль;
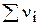 - сума кількостей моль усіх коспонентів, моль.
- сума кількостей моль усіх коспонентів, моль.
Моляльна концентрація (моляльність) (m) - відношення кількості розчиненої речовини до маси розчинника. Одиниці вимірювання - моль/кг.
m = 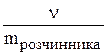 ,
,
де 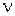 - кількість речовини, моль;
- кількість речовини, моль;
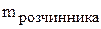 - маса розчинника, кг.
- маса розчинника, кг.
Гідрати, кристалогідрати
Кількість тепла, яка поглинається (чи виділяється) під час розчинення одного моля речовини, називається теплотою розчинення цієї речовини.
У теперішній час встановлено, що під час розчинення багатьох речовин їх молекули (чи іони) зв’язуються з молекулами розчинника, утворюючи сполуки, які називають сольватами; цей процес називають сольватацією. Якщо розчинником є вода, ці сполуки називають гідратами, а процес їх утворення - гідратацією.
Речовини, у кристали яких входять молекули води, називають кристалогідратами, а вода, яка в них міститься - кристалізаційною. Склад кристалогідратів прийнято відображати формулами, які показують яку кількість кристалізаційної води містить кристалогідрат. Наприклад, CuSO4×5H2O - кристалогідрат купрум(II) сульфату містить на 1 моль CuSO4 5 моль Н2О.
Розчинність - здатність речовин розчинятись в тому чи іншому розчиннику. Мірою розчинності речовини при даних умовах є вміст її у насиченому розчині. Чисельно розчинність може бути виражена такими способами, що і склад.
Коефіцієнт розчинності - число одиниць маси безводної речовини, яке насичує за даних умов 100 одиниць маси розчинника. Якщо в 100 г Н2О розчиняється більше 10 г речовини, її називають гарно розчинною; якщо розчиняється менше 1 г речовини - малорозчинною; якщо розчиняється менше 0,01 г - нерозчинною.
Розчинність речовин, які знаходяться у твердому стані, залежить від температури і практично не залежить від тиску. Під час розчинення рідин у рідинах розчинність залежить від температури і мало залежить від тиску.
Закон розподілу: речовина, яка здатна розчинятись в двох розчинниках, що не змішуються, розподіляється між ними так, що відношення її концентрацій у цих розчинниках за сталою температурою є постійним, незалежно від загальної кількості розчиненої речовини.
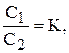
де К - коефіцієнт розподілу.
Екстракція - спосіб вилучення розчиненої речовини з розчину за допомогою іншого розчинника.
Розчинність газів у воді залежить від температури та тиску.
Закон Генрі: концентрація газу у розчині прямопропорційна парціальному тиску цього газу над розчином.
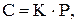
де С - масова концентрація газу в насиченому розчині,
Р - парціальний тиск,
К - коефіцієнт Генрі.
Теорія електролітичної дисоціації
Електроліт - речовина, молекули якої можуть розпадатися на іони за певних умов і завдяки цьому вона проводить електричний струм.
Основні положення сучасної теорії електролітичної дисоціації:
1. Під час розчинення у полярному розчиннику або розплавленні молекули електроліту розпадаються на іони.
Катіони: Н+, NH4+, катіони металів.
Аніони: ОН-, аніони кислотних залишків (Cl-, Br--прості; SO42-, NO3-- складні).
2. Дисоціація - процес зворотній, як правило, не іде до кінця. Прямий процес називається дисоціація, а зворотній - асоціація.
3. Іони в розчині знаходяться в хаотичному русі, але якщо розчин електроліту помістити в електричне поле іони набувають напрямленого руху.
Кількісні характеристики процесу дисоціації
· Ступінь дисоціації (a) - відношення кількості молекул, що розпалися на іони до загальної кількості молекул електроліту, що розчинили в розчині. Вимірюється в долях одиниці чи у відсотках.
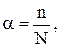
де n - кількість молекул, що розпалися на іони,
N - загальна кількість молекул електроліту.
Електроліти підрозділяють на сильні та слабкі. Якщо a=1 чи a=100%, електроліт вважають сильним. Якщо a<0,03 чи a<3%, електроліт вважають слабким.
Сильні електроліти: а) кислоти (HCl, HBr, HI, H2SO4, HNO3, HClO4…);
б) основи (LiOH, KOH, NaOH, Ba(OH)2, Ca(OH)2…);
в) усі солі, що розчиняються у воді.
· Константа дисоціації (Кд) - константа рівноваги процесу дисоціації. Константа характеризує процес дисоціації слабких електролітів. Наприклад, для одноосновної слабкої кислоти процес дисоціації можна записати так:
КАÛК++А- .
Відповідно константа дисоціації буде дорівнювати:
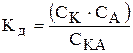 ,
,
де 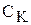 - концентрація катіону, моль/л;
- концентрація катіону, моль/л;
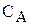 - концентрація аніону, моль/л;
- концентрація аніону, моль/л;
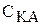 - концентрація кислоти, моль/л.
- концентрація кислоти, моль/л.
Багатоосновні кислоти та гідроксиди двох- і більш валентних металів дисоціюють за ступенями.
Закон розведення Оствальда:
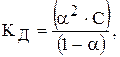
де 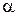 - ступінь дисоціації,
- ступінь дисоціації,
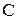 - концентрація електроліту, моль/л.
- концентрація електроліту, моль/л.
Для слабкого електроліту закон має вигляд:
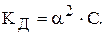
Стан сильних електролітів у розчині. Активність. Коефіцієнт активності
Теорія Арреніуса в своїх висновках виходить із того, що рухомість іонів не залежить від їх концентрації. Але іони - це електрично заряджені частинки. Якщо в розчинах слабких електролітів, де концентрація іонів мала, силами електростатичної взаємодії можна знехтувати, то в розчинах сильних електролітів так зробити не можна. У насичених розчинах сильних електролітів сили міжіонного притяжіння та відштовхування стають достатньо великими. Із-за них відбувається відхилення сильних електролітів від закону діючих мас.
Слід вважати, що у водних розчинах усі сильні електроліти, незалежно від їх концентрації, повністю іонізовані. Однак, у таких розчинах іони не вільні. Їх рух залежить від взаємного притяжіння друг до друга. Завдяки цьому притяжінню кожен іон як би оточений шаром протилежно заряджених іонів, який називають “іонною атмосферою”. Чим більше концентрація розчину, тим сильніше проявляється “гальмуюча” дія іонної атмосфери. Тому усі властивості розчину електроліту, які залежать від концентрації, проявляються так, як у випадку, коли число іонів у розчині менше, чим це відповідає концентрації, яку розрахували для повної дисоціації електроліту.
Для оцінювання цієї послабленої здатності іонів до реакцій у теперішній час застосовується величина, яку називають активністю. Під активністю іона розуміють ту ефективну умовну концентрацію його, відповідно якій він діє при хімічних реакціях. Активність іона дорівнює його концентрації, помноженої на коефіцієнт активності (g):
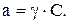
Якщо коефіцієнт активності менше одиниці, це означає, що дія іону обмежена; якщо коефіцієнт активності дорівнює одиниці, то дія іону необмежена. Останній випадок має місце тільки в дуже розбавлених розчинах, де іони знаходяться настільки далеко друг від друга, що дією міжіонних сил можна знехтувати.
Користуючись замість концентрацій активностями іонів, можна застосовувати закон діючих мас до сильних електролітів.
Дисоціація кислот, основ і солей. Зміщення рівноваги
Багатоосновні кислоти дисоціюють за ступенями. Наприклад,
H3PO4ÛH++H2PO4-
H2PO4-ÛH++HPO42-
HPO42-ÛH++PO43-.
Багатокислотні основи теж дисоціюють за ступенями. Наприклад,
Ba(OH)2ÛBaOH++OH-
BaOH+ÛBa2++OH-.
Середні солі дисоціюють на іони металів та кислотних залишків. Наприклад,
Na2SO4Û2Na++SO42-.
Кислі солі дисоціюють, як багатоосновні кислоти - за ступенями. Наприклад,
NaHCO3ÛNa++HCO3-
HCO3-ÛH++CO32-.
Однак, ступінь дисоціації за другим ступенем дуже мала і розчин кислої солі містить незначну кількість гідроген-іонів.
Основні солі - дисоціюють на іони основних та кислотних залишків. Наприклад,
Fe(OH)Cl2ÛFeOH2++2Cl-.
Вторинна дисоціація іонів основних залишків на іони металу та гідроксид-іони майже не відбувається.
Зміщення рівноваги. Дія однойменного іону
Рівновага в розчинах електролітів між недисоційованими молекулами та їх іонами, як будь-яка хімічна рівновага, зберігається незмінною тільки за сталих зовнішніх умов. Зміна умов веде до зміщення рівноваги в який-небудь бік. Збільшення об’єму розчину під час додавання до нього води зміщує рівновагу у бік утворення нової кількості іонів (збільшується ступінь дисоціації), і навпаки. Збільшення концентрації одного з іонів веде до зміщення рівноваги у бік утворення недисоційованих молекул. Це означає, що введення в розчин слабкого електроліту однойменних іонів зменшує ступінь дисоціації цього електроліту. І навпаки, зменшення концентрації одного з іонів веде до збільшення дисоціації молекул.
Під час розчинення твердої речовини у воді розчинення зупиняється, коли розчин стає насиченим. Під час розчинення сильних електролітів, наприклад, солей, кристали яких побудовані з іонів, в розчин переходять не молекули, а окремі іони. Це означає, що рівновага в насиченому розчині встановлюється між іонами, які перейшли в розчин та іонами, які знаходяться в кристалах солі.
Наприклад, у насиченому розчині кальцій сульфату повинна існувати рівновага:
Сa2+SO42-Û Сa2+ +SO42-.
Застосуємо до цього рівняння закон діючих мас:
К=[ Сa2+ ]×[ SO42-].
Таким чином, в насиченому розчині малорозчинного електроліту добуток концентрацій його іонів є величина стала за даною температурою. Ця величина характеризує здатність електроліту розчинятись. Її називають добутком розчинностіелектроліту і позначають ДР.
ДР(CaSO4)= [ Сa2+ ]×[ SO42-].
Розчинність електроліту зменшується від введення в розчин однойменних іонів. Винятком є випадки, коли відбувається зв’язування одного з іонів розчину з іонами, що вводять, в наслідок чого утворюються більш складні (комплексні) іони.
Добуток розчинності є сталою величиною тільки для малорозчинних речовин.
Аналітичні реакції у розчинах електролітів як реакції іонів
Коли ми розчиняємо який-небудь сильний електроліт у воді, то одержуємо розчин, який містить іони, а не молекули даного електроліту. Кожен іон має свої характерні властивості, які він зберігає в будь-якому розчині незалежно від присутності інших іонів. Таким чином, розчин електроліту - це суміш іонів із молекулами води. Це означає, що під час змішування розчинів двох сильних електролітів у реакцію можуть вступати тільки іони. Тому і результат реакції повинен залежати тільки від того, які іони знаходились в розчинах.
Наприклад, під час протікання трьох наступних реакцій випадає білий осад аргентум хлориду:
AgNO3+NaCl=AgCl+NaNO3,
Ag2SO4+CuCl2=AgCl+CuSO4,
CH3COOAg+KCl=AgCl+CH3COOK.
Висновок: реакції між електролітами - це реакції їх іонів.
Іонні рівняння
У звичайних хімічних реакціях не враховується дисоціація молекул на іони, тому для виразу сутності реакцій, що перебігають під час взаємодії між електролітами, користуються іонними рівняннями.
Складання іонних рівнянь:
·Написати рівняння реакції у молекулярній формі.
·Переписати це рівняння, враховуючи, що нерозчинні речовини і слабкі електроліти присутні в розчині у вигляді молекул, а інші - у вигляді іонів.
·Виключити іони, які не приймають участь у реакції, тобто ті, що зустрічаються в обох частинах рівняння у однаковій кількості.
Наприклад, напишемо іонне рівняння для наступної реакції:
AgNO3+NaCl=AgCl¯+NaNO3.
Перепишемо його в наступному вигляді:
Ag++NO3-+Na++Cl-=AgCl¯+Na++NO3-
Скорочуємо однакові іони та одержуємо іонне рівняння:
Ag++Cl-=AgCl¯.
Це - іонне рівняння реакції, яку ми розглядали. Воно простіше за молекулярне рівняння і в той же час виражає сутність реакції, що перебігає. Зрозуміло, що іонні рівняння, на відміну від звичайних молекулярних рівнянь, відносяться не до однієї реакції між певними речовинами, а охоплюють цілу групу аналогічних реакцій. У цьому полягає їх головна цінність та значення.
Дисоціація води
Реакції, які застосовують в аналітичній хімії перебігають найчастіше у водних розчинах. Вода - слабкий електроліт, який іонізується згідно з рівнянням:
Н2О®Н++ОН-.
Оскільки з кожної молекули під час іонізації утворюється по одному іону Н+ та ОН-, концентрації їх у чистій воді однакові: [Н+]=[ОН-]=10-7 моль/л (при 25°С). Процес розпаду можна охарактеризувати відповідною константою:
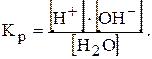
Кр×[Н2О]=[Н+]×[ОН-]=КW - іонний добуток води
За температури 25°С КW=10-7×10-7=10-14=const. Якщо [Н+]=[ОН-]=10-7 розчин називають нейтральним. Якщо [Н+]>10-7 >[ОН-] розчин називають кислим. Якщо [Н+]<10-7 <[ОН-] розчин називають лужним.
Реакцію будь-якого розчину можна охарактеризувати кількісно, вказавши, яка в ньому концентрація гідроген-іонів. Замість концентрації гідроген-іонів краще користуватись від’ємним логарифмом цієї величини, який називають водневим показником та позначають знаком рН:
рН=-lg[Н+].
Якщо рН=7 середовище називають нейтральним. Якщо рН>7 середовище називають лужним. Якщо рН<7 середовище називають кислим.
Поряд із водневим показником часто застосовують гідроксильний показник рОН:
рОН=-lg[ОН].
Якщо рівняння [Н+][ОН-]=10-14 прологарифмувати та замінити знаки на зворотні, то одержимо рівняння:
рН+рОН=14.
Дата добавления: 2016-12-16; просмотров: 2580;
