Методи комплексонометричного титрування
1. Пряме титрування: досліджуваний розчин титрують у лужному середовищі при рН»10 трилоном Б; індикатор ¾ еріохром чорний Т чи мурексид. Таким методом визначають: Mg, Ca, Ba, Zn, Co, Ni, Cu, Fe(III).
2. Зворотнє титрування. Цей метод використовують, коли неможливо підібрати індикатор чи комплексоутворення іде повільно. До досліджуваного розчину додають певний об’єм розчину трилона Б, нагрівають та відтитровують надлишок трилону Б розчином магній сульфоту. Точку еквівалентності визначають за допомогою індикатору, що реагує на магній(ІІ)-катіони.
3. Титрування замісника. Метод базується на тому, що комплекс магній(ІІ)-катіонів з трилоном Б менш стійкиий, чим комплекси з іншими металами, тому проводять реакцію:
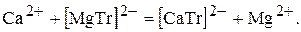
Магній(ІІ)-катіони, які виділяються відтитровують розчином трилону Б.
4. Метод алкаліметричного титрування. Розчин, який містить катіони металу, титрують розчином трилону Б:
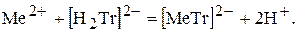
Під час перебігу реакції виділяється еквівалентна кількість гідроген-катіонв, яку титрують розчином лугу у присутності кислотно-основного індикатору.
Визначення загальної жорсткості води
Загальна жорсткість визначається сумою тимчасової (карбонатної) та постійної жорсткості: Жзаг=Жтимч+Жпост. Метод визначення загальної жорсткості базується на титруванні певної порції досліджуваної води розчином трилона Б 0,01 моль/л за рН=10-12 у присутності індикатору ¾ еріохром чорного Т. Лужне середовище утворюється під час додавання до досліджуваної проби амоніачного буферного розчину.
Методика виконання: У конічну колбу вмісткістю 250-300 мл поміщають 100 мл досліджуваної води, яку відміряють за допомогою мірної колби. Потім додають 5 мл амоніачного буферного розчину, 0,1 г сухого індикатору ¾ еріохром чорного Т. З катіонами металів індикатор утворює комплексні сполуки винно-червоного кольору:
Сa2+ + HInd2 -= CaInd- + H+, Mg2+ + HInd2 -= MgInd -+ H+.
винно-червоний винно-червоний
Потім проводять титрування розчином трилона Б. У точці еквівалентності винно-червоний колір змінюється на синій внаслідок накопичення аніонів індикатору.
CaInd- + [H2Tr]2- = [CaTr]2- + HInd- + H+,
винно-червоний синій
MgInd -+ [H2Tr]2- = [MgTr]2- + HInd- + H+.
винно-червоний синій
Загальну жорсткість води розраховують за формулою:
Жзаг= 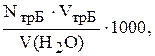 мг-екв/л,
мг-екв/л,
де NтрБ ¾ молярна концентрація еквівалента розчину трилона Б, моль/л;
VтрБ ¾ об’єм розчину трилона Б, який пішов на титрування, мл;
V(H2O) ¾ об’єм розчину води, мл.
Література: [3] с. 29-96; [8] с. 303-364
ГРАВІМЕТРИЧНИЙ (ВАГОВИЙ) АНАЛІЗ
Лекція №19 (2 години)
План
1.Сутність, позитивні та негативні сторони вагового методу, та сфери його застосування.
2. Техніка роботи, обладнання та розрахунки у гравіметрії.
3. Основні вимоги до осаджуваної та вагової форм осаду.
4. Оптимальні умови одержання кристалічних і аморфних осадів в гравіметрії.
5. Застосування гравіметричних методів
Сутність, позитивні та негативні сторони вагового методу, та сфери його застосування
Гравіметричний аналіз заключається у виділенні речовини у чистому вигляді і її зважуванні. Найчастіше таке виділення проводять осадженням. Іноді компонент, що визначають, виділяють у вигляді летучої сполуки. Похибка визначення не перевищує 0,1-0,2 %. Гравіметрія - це абсолютний (безеталонний) метод.
Недоліком гравіметричних методів є тривалість визначення, особливо під час серійних аналізів великої кількості проб, а також неселективність - реагенти-осаджувачі за невеликим виключенням рідко бувають специфічними. Тому часто необхідні попередні розділення.
Аналітичним сигналом в гравіметрії є маса. Масу знаходять шляхом порівняння з іншою відомою масою за допомогою терезів. Відомі маси, які визначені з великою точністю, оформлюють звичайно у вигляді металевих гірь та називають різноважками.
Гравіметричне визначення складається з декількох етапів:
· Осадження сполуки, що містить речовину, яку визначають (її називають осаджуваною формою).
· Фільтрування одержаної суміші для відділення осаду від надосадочної рідини.
· Промивання осаду для видалення надосадочної рідини і адсорбованих домішок з його поверхні.
· Висушування за низької температури для видалення води чи за високої температури для перетворення осаду у більш придатну для зважування форму (гравіметричну форму).
· Зважуваня одержаного осаду.
Більшість аналітичних методів використовує залежність між фізичною властивістю, яку вимірюють, і кількістю визначаємої речовини:
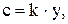
де k - константа. У гравіметрії k - це гравіметричний фактор F.
Таблиця 12
Загальна характеристика гравіметричного аналізу
| Операції | Посуд та обладнання | |
| Взяття точної наважки | Аналітичні терези, бюкси, годинникові скельця, склянки, технічні терези | |
| Переведення наважки у розчин | Розчинення | Хімічні склянки, годинникове скло, воднева або піщана баня, електроплита, |
| Сплавлення | Ступка, фарфорові, кварцеві, платинові, залізні, нікелеві тиглі, шпатель, скляна паличка, газовий пальник, фарфоровий трикутник, електрична плита, тигельні щипці, фарфорова чи платинова чашка. | |
| Осадження | Хімічні склянки, бюретка, штатив, газовий пальник, асбестова сітка, скляна паличка з гумовим кінцем. | |
| Відфільтровування та промивання | Фільтруючі тиглі (фарфорові та скляні), фільтрувальний папір, прилад для вакуумного фільтрування, лійка, кільце, штатив, скляна паличка. | |
| Висушування та прокалювання | Нагрівальний прилад, ексікатор, аналітичні терези |
Техніка роботи, обладнання та розрахунки у гравіметрії
Взяття точної наважки
Одним з основних приладів у кількісному аналізі являються аналітичні терези ¾ прилад для визначення маси речовини. Звичайно вони дозволяють визначати масу з точністю до 0,0001 г. Вага та маса зв’язані співвідношенням:
F=m×g,
де F ¾ вага ¾ сила, з якою тіло притягується до Землі;
g ¾ прискорення сили тяжкості;
m ¾ маса тіла.
Терези використовують для знаходження невідомої маси речовини шляхом порівняння її з відомою масою різноважок.
Правила користування аналітичними терезами
1. Навантаження на чашки не повинно перевищувати граничного, вказаного для даної системи терезів.
2. Предмет, який зважують, та різноважки можна поміщати на чашки терезів та знімати з чашек тільки якщо арретир закритий.
3. Температура предмета, який зважують, та температура оточуючої ваги повітря повинні бути однаковими (неможна зважувати теплі предмети).
4. Речовини, які зважують, повинні знаходитись у чистому та сухому посуді (бюкси, тиглі, годинникові скельця та ін.). Речовини не можна поміщати безпосередньо на чашки терезів. Леткі та гігроскопічні речовини необхідно зважувати у закритих сосудах.
5. Дверцята терезів під час зважування повинні бути закриті.
6. Усі зважування для даного аналізу повинні проводитись на одних терезах.
Аналіз починається з узяття наважки досліджуваної речовини. Перед цим необхідно вибрати її приблизну величину, яка залежить від ряда факторів. Величина наважки визначається приблизним вмістом визначаємого компонента у пробі. У загальному випадку наважка не повинна бути ні великою, ні малою. Величина наважки залежить від характеру осаджуваної форми. Осад повинен виділятись у таких кількостях, щоб його можна було легко відфільтрувати та промити. Тому, якщо мова йде про кристалічні осади, то слід брати таку наважку, щоб маса гравіметричної форми складала 0,3-0,5 г. Якщо виділяється об’ємний аморфний осад, то наважка досліджуваної речовини повинна бути такою, щоб маса гравіметричної форми складала 0,1-0,2 г. Наважка однієї і той же речовини може бути різною в залежності від вибраного методу аналізу.
Наважки твердих речовин беруть звичайно у бюксах, скляних стаканчиках, на скляних скельцях. Бюксами користуються обов’язково під час зважування гігроскопічних та летких речовин.
Існує два основні методи узяття точної наважки.
1. Зважують на аналітичних терезах (з точністю до 0,0001 г) чистий сухий бюкс (стаканчик, годинникове скло). Потім поміщають його на технічні терези, насипають в нього та відзважують (з точністю до 0,01 г) досліджувану речовину. Після чого бюкс з речовиною зважують на аналітичних терезах (з точністю до 0,0001 г). Різниця двох зважувань на аналітичних терезах дає масу взятої наважки. Взважену речовину обережно пересипають у хімічний стакан (чи через суху лійку у колбу), після чого змивають у стакан водою частинки речовини, що залишилися у бюксі та у лійці.
2. На технічних терезах спочатку зважують пустий бюкс, а потім з досліджуваною речовиною. Поміщають бюкс з речовиною на аналітичні терези та зважують (з точністю до 0,0001 г). Обережно пересипають речовину у стакан (чи через суху лійку у колбу). Бюкс знову зважують на аналітичних терезах. За різницею двох зважувань на аналітичних терезах знаходять масу наважки. Цей спосіб називається “взяттям наважки за різницею”, він найбільш часто застосовується у гравіметрії.
Рідини для аналізу теж беруть за різницею, завжди користуються для цього бюксами.
Дата добавления: 2016-12-16; просмотров: 1530;
