Ізомерiя комплексних сполук
Комплекснi сполуки мають сталий склад i певне розташування лiгандiв навколо центрального атома. Для багатьох з них характерне явище iзомерії, тобто iснування кiлькох сполук, однакових за якiсним i кiлькiсним складом, але рiзних за будовою та властивостями. Є рiзнi види iзoмepiї координацiйних сполук, для КС з бiолiган-дами важливими є такі: просторова, оптична та гідратна.
Просторова, або геометрична iзомерiя зумовлена рiзним розмiщенням неоднорiдних лiгандiв у внутрiшнiй координацiйнiй сферi комплексу квадратно-площинної або октаедричної будови.
 |
Наприклад, для квадратного комплексу Pt(NH3)2Cl2, iснують два геометричнi iзомери ( цис- i транс-iзомери).
Вони вiдрiзняються забарвленням, дипольним моментом та реакційною здатністю.
Оптичнi iзомерu − це такі ізомери, молекули яких та їх дзеркальне вiдображення несумiснi (як права та ліва руки). Оптично активнi форми мають асиметричну структуру та по-різному повертають площину поляризованого свiтла; один вправо (L-iзомер), а другий − влiво (D-iзомер). Цей факт має особливе значення для бiологiчних систем, оскiльки живий органiзм складасться тiльки з L-iзомерних амiнокислот.
 Вимірювання оптичної активності за допомогою поляриметра: 1–джерело світла, 2 – неполяризоване світло, 3 – поляризатор, 4 – поляризоване світло, 5 – кювета з розчином речовини, 6 – оптичне обертання , 7 – аналізатор, 8 – спостерігач.
Вимірювання оптичної активності за допомогою поляриметра: 1–джерело світла, 2 – неполяризоване світло, 3 – поляризатор, 4 – поляризоване світло, 5 – кювета з розчином речовини, 6 – оптичне обертання , 7 – аналізатор, 8 – спостерігач.
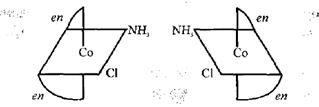
Наприклад, оптичнi iзомери координацiйноi сполуки [Co(en)NH3Cl]Cl2:
Структурнi iзомери утворюютъся в результатi iзoмepiї звʼязкiв за наявностi альтернативних способiв координацiї одного й того самого лiганду. Наприклад, iснують структурнi iзомери монодентатних лiгандiв, що мiстять по два донорнi атоми:
 |
Iзомерiю, зумовлену неоднаковим розподiлом молекул води та йонiв зовнiшньої сфери мiж внутрiшньою i зовнiшньою сферами комплексних сполук, називають гiдратною. Наприклад, кристалогiдрату CrCl3×6H2О вiдповiдають чотири iзомери [Cr(H2О)6]C13 (I), [Cr(Н2О)5Cl]Cl2·H2О (II), [Cr(H2О)4CI2]Cl·2H2О (ІII), [Cr(H2О)3Cl3]·3H2О (IV), якi вiдрiзняються забарвленням.
7. Властивості комплексних сполук
Дисоціація і стійкість комплексних сполук
Іони зовнішньої сфери зв’язані з комплексом в основному силами електростатичної взаємодії (тобто іонним хімічним зв’язком) і в розчинах дисоціюють подібно сильним електролітам. Ця дисоціація називається первинною і відбувається майже повністю:
[Cu(NH3)4]SO4 « [Cu(NH3)4] 2+ + SO42-.
Поряд з цим процесом у незначному ступені відбувається дисоціація внутрішньої сфери комплексу, в якої ліганди повўязані з комплексоутворювачем ковалентними зв’язками, утвореними внаслідок донорно-акцепторної взаємодії:
[Cu(NH3)4] 2+ « Cu2+ + 4 NH3.
Встановлюється рівновага між комплексом, комплексоутворювачем і лігандами. Використовуючи закон діючих мас до цього рівняння, визначаємо вираз для константи дисоціації, яка в даному випадку називається константою нестійкості комплексного іона:
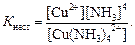
Значення констант нестійкості коливаються в широких межах і є мірою стійкості комплексів. Чим стійкіше комплексний іон, тим менше його константа нестійкості. Так, серед однотипних сполук:
[Ag(NO2)2]- (Кнест = 1,3 .10-3);
[Ag(CN)2]- (Кнест = 1. 10-21);
[Ag(NH3)2]+ (Кнест = 6,8 .10-8);
[Ag(S2O3)2]3- (Кнест = 1.10-13).
найбільш стійким є комплекс [Ag(CN)2]- , а найменш – [Ag(NO2)2]-.
Значення констант нестійкості надаються в таблицях.
Приклад. Визначити концентрацію Ag+ в 0,005М розчині K[Ag(CN)2], який містить, крім того, 0,01 моля КCN в 1 л розчину.
Розв’язання:
Дисоціація комплексу відбувається за рівнянням:
[Ag(CN)2]- « Ag+ + 2CN- .
В присутності надлишку іонів CN-, утворених внаслідок дисоціації KСN, рівновага зміщується у бік недисоційованого комплексу, і кількістю CN-, утворених при дисоціації [Ag(CN)2]-, можна нехтувати. Тоді
[CN-] =[KСN] = 0,01 моль/л.
З тієї ж причини можна прийняти, що [Ag(CN)2]- = 0,05 моль/л, тоді
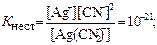

Відповідь: концентрація іонів Ag + дорівнює 5.10-19 моль/л.
У сучасній хiмiчнiй i бiохiмiчнiй лiтературi частiше використовують величину, обернену до константи дисоцiацiї комплексу, яку називають константою утворення комплексу, або константою стiйкостi, i позначають β або Kст:
[Ag(CN)2]- « Ag+ + 2CN- .
 β = = 1021.
β = = 1021.
Якщо комплекс дисоціює ступінчасто, то сумарна константа стійкості дорівнює добутку констант окремих стадій:
β = β1× β2× … βn.
Для спрощения частiше використовують не абсолютнi величини цих констант, а їx десятковi логарифми, якi позначаються рβ:
рβ = lgβ
За допомоrою констант утворення комплексу теж оцiнюють їх стiйкiсть у розчинах. Чим бiльше значення константи стiйкостi i вiдповiдно рβ, тим стiйкiший комплексний йон у розчинi.
Наприклад, серед комплексних йонiв Цинку найстiйкiшим є комплексонат [Zn(en)]2−, оскiльки його константа стiйкостi найбiльша (β = 1,82·1016, рβ = 16,26).
Поняття про лабiльнi та iнертнi комплекси. Крiм дисоцiацiї в розчинах, комплекснi йони можуть зазнавати певних змiн у склад лігандiв, або замiщення лiгандiв. Наприклад, бiолоriчно активний комплекс Ферум(ІІ) порфiрин, що входить до складу гемоглобiну, повинен легко вiддавати кисень клiтинам органiзму. У результатi цього звʼязок комплексоутворювача з киснем Fe(II)−О2 має змiнюватися на його звʼязок з водою Fe(II)−ОН2, тобто на сполуку з сильнiшим лiгандом, яким є вода (його енергія звʼязку більша,ніж звʼязку Fe(II)−О2).
 |
Комплекси, що пiдлягають швидкому обмiну лiгандами в розчинах, називають лабiльними. Ступiнь замiщення лiгандiв залежить вiд природи металу та лiгандiв i не має безпосереднього звʼязку зi стiйкiстю комплексiв. Так, цiанiдний комплекс Нiкелю [Ni(CN)4]2− є стiйким (β = 1030), але досить лабiльним. Вiн обмiнюеться лiгандами за короткий промiжок часу.
Бiльшiсть вивчених комплексiв, в яких центральним атомом є йони Со3+, Cr3+, Cu2+, є iнертними. Iнертнi комплекси зазнають повiльного обмiну лiгандами, переважно впродовж багатьох годин або дiб. Як правило, внутрiшнi комплекси характеризуються бiльшою iнертнiстю вiдносно конкуруючих лiгандiв, нiж зовнiшнi.
Bнутрішні комплекси утворюються при d2sp3-гiбридизацiї атомних орбiталей центрального атома.
Якщо в гiбридизацiї АО беруть участь зовнiшнi d-орбiталi комплексоутворювача (тип гiбридизацiї sp3d2), то утворенi комплекснi йони називаютъ зовнiшнiми комплексами. У переважнiй бiльшастi вони належать до лабiльних комплексiв.
Стiйкiсть комплексiв визначається мiцністю звʼязку мiж металом та лiгандом Me-L. Вона змiнюється в широких межах i поступово зростає при переходi вiд легких металiв до важких.
За здатнiстю до комплексоутворення йони металiв розташовують у такому порядку:
Лужнi метали < Лужноземельнi метали < Mg2+ < Перехiднi метали.
Як правило, лужнi, лужноземельнi метали та Магнiй утворюють найстiйкiшi комплекси з оксоанiонами О2− та з полiдентатними лiгандами (комплексонами), а d-елементи (перехiднi метали i Цинк) легко вступають у реакцit комплексоутворення зi сполуками, що мiстять iншi донорнi атоми – O, N, S.
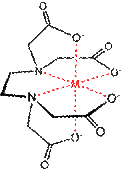 Дуже стiйкi комплекси утворюються i в результатi реакцiї хелатоутворення з органiчними сполуками типу полiамiнiв, амiнокислот, полiкислот тощо. Цi лiганди приєднуються до центрального атома не одним, а кількома атомами, утворюючи замкненi цикли − хелати. Наприклад, структура хелатного комплексу металу з етилендiамiном має вигляд:
Дуже стiйкi комплекси утворюються i в результатi реакцiї хелатоутворення з органiчними сполуками типу полiамiнiв, амiнокислот, полiкислот тощо. Цi лiганди приєднуються до центрального атома не одним, а кількома атомами, утворюючи замкненi цикли − хелати. Наприклад, структура хелатного комплексу металу з етилендiамiном має вигляд:
8. Приклади біокомплексів та їх біологічне значення
Комплекси з амінокислотами
Амiнокислоти (особливо ті, що мають додатковi електронодонорнi групи, що входять до складу молекул деяких амiнокислот − цистеїну, цистину або гiстидину) утворюють з d-елементами дуже стiйкi комплекси. Так, рβ комплексної сполуки Zn(ІІ) з цистеiном (Cys) дорiвнює 17,54, а з глiцином − 9,96. Гiстидин (Нis) i цистеїн координуються за допомогою груп –NН2 i -SH, причому карбоксильна група –СОО− залишається незвʼязаною. Аспарагiнова кислота (Asp), що мiстить у молекулі двi карбоксильнi та одну амiногрупу, виступае як тридснтатний лiганд.
Отже, анiони амiнокислот утворюють стiйкi комплекси з йонами d-елементiв, причому бiльшiсть амiнокислот взаємодiють як бiдентатнi лiганди. Стiйкiсть комплексiв бiометалiв з амiнокислотами та бiлками має важливе значения для функцiонування живих систем.
Комплекси з білками
Бiлки − це бiологiчнi полiмери, якi складаються з залишкiв рiзних α-амiнокислот, обʼєднаних у макромолекулу за допомогою пептидного звʼязку.
При утвореннi комплексiв бiометалу з молекулами бiлкiв донорами електронних пар виступають кiнцевi карбоксильнi – СОО− i амiногрупи −NH2 залишкiв амiнокислот i рiдко − атоми Нiтрогену пептидного звʼязку. У комплексних сполуках з бiлками йони перехiдних металiв є складовими фрагментами активних центрiв бiльшостi металоферментiв.
Наприклад, активним центром мiоглобiну та гемоглобiну, тобто мiсцем звʼязування молекул кисню з цими сполуками, є гем.
Комплекси з гормонами, нуклеотідами, нуклеїновими кислотами
Iншi важливі бiологiчно активнi речовини − гормони, нуклеотиди та нуклеїновi кислоти теж здатнi вступати в реакцiї комплексоутворення з бiометалами, оскiльки вони мiстять в складi молекул електронодонорнi атоми: О, N, S, Р.
Гормони виконують в органiзмi функцiю активаторiв або iнгiбiтopiв ферментiв. За хiмiчною природою гормони − це похiднi амiнокислот, або полiпептиди. Тому вони мiстять такі ж функціональні групи, що й амінокислоти.
Так, бiлково-пептидний гормон iнсулiн легко утворює координацiйнi сполуки з іонами d-елементiв, особливо стiйкi з такими йонами, як Zn2+ та Со2+. Це використовують у фармацевтичнiй практицi для виготовлення лiкарських форм цинк-iнсулiну, який характеризується пролонгованою дiєю.
Важливу роль у функцiонуваннi органiзму відiграють такi природнi бiологiчно активнi сполуки, як нуклеотиди та нуклеїновi кислоти. Наприклад, АТФ бєре безпосередню участь у процесах енергообмiну в органiзмi. Проте для змiщення рiвноваги реакцiї гiдролiзу АТФ необхiднi йони Mg2+, Са2+. Вони утворюють стiйкi комплекси з продуктами гідролізу, внаслідок чого досяrаеться максимальна повнота перебiгу цiєї реакцiї.
Комплекси вітамінів
При утвореннi комплексiв з металами в ролi лiгандiв можуть виступати й деякi вiтамiни, що мiстять донорнi атоми. Це наприклад, вiтамiни rрупи В − тiамiн (В1), рибофлавiн (B2), пантотенова кислота (В3), пiридоксин (В6), фолiєва кислота (В10), В12 (хелат Co(III) з кориновим циклом), а також вiтамiни Н (бiотин), РР (нiкотинова кислота) та iї амід.
Отже, в орrанiзмi кожний бiометал i бiолiганд виконуе свої специфiчнi функції, причому один йон металу, як правило, не може бути замiнений на iнший. Тiльки метали, що маютъ однаковi значення координацiйних чисел, близькi величини йонних радiусiв та ентальпiй йонiзацiї здатнi замiщувати один одного у бiокомплексах.
| Формула | Назва | Скорочене позначення |
| H2N–CH2–COOH | Гліцин | глі |
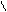 H3C–CH–COOH
NH2 H3C–CH–COOH
NH2
| Аланін | ала |
 H3C–СН–CH–COOH
H3C NH2 H3C–СН–CH–COOH
H3C NH2
| Валін | вал |
H3C–СН–СН3–CH–COOH
 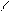 H3C NH2 H3C NH2
| Лейцин | лей |
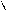 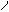 H3C–CH2–CH–CH–COOH
CH3 NH2 H3C–CH2–CH–CH–COOH
CH3 NH2
| Ізолейцин | іле |
HOOC—CH2—CH—COOH
  NH2 NH2
| Аспарагінова кислота | асп |
HOOC–CH2–CH2–CH–COOH
  NH2 NH2
| Глютамінова кислота | глу |
Кориновий цикл Гем гемоглобіну
 |
 |
Дата добавления: 2016-11-28; просмотров: 1284;
