Номенклатура комплексних сполук
Називаючи комплексний катіон, спочатку вказують числа ( ді-, три-, тетра- і т.п.) і назви лігандів – аніонів з закінченням – о (Сl– -хлоро, ОН- - гідроксо- і та ін.), причому замість назв "вода" і "амоніак" вказуються префікси аква- та амін‑, і останнім вказують комплексоутворювач, показуючи його ступінь окислення. Наприклад: [Pt(NH3)3Cl]Cl – хлоротриамінплатина (ІІ) хлорид, [Co(NH3)5Br]SO4 – бромопентаамінкобальт (ІІІ) сульфат.
Назва комплексного аніона складається аналогічно і закінчується суфіксом -ат. Наприклад: Ba[Cr(NH3)2(CNS)4]2 - барій тетрароданодіамінхромат (ІІІ).
При назві нейтрального комплексу комплексоутворювач вказують у називному відмінку, не означаючи ступеня його окиснення: [Pt(NH3)2Cl2] –дихлородіамінплатина.
3. Класифікація комплексних сполук
Комплексні сполуки класифікуються за різноманітними принципами.
1. За належністю певному класу сполук:
Комплексні кислоти Н2[SiF6], H[AuCl4].
Комплексні основи [Ag(NH3)2]OH, [Co(H2O)6](OH)2.
Комплексні солі K4[Fe(CN)6], K2[HgI4], [Cr(NH3)6]Cl3.
2. За природою лігандів:
| Ліганд | Назва комплексів | Приклад |
| Н2О NH3 ОН- Кислотні залишки: | аквакомплекси амінкомплекси гідроксокомплекси ацидокомплекси цианідні йодидні флуоридні | [Co(H2O)6](OH)2 [Cr(NH3)6]Cl3 Na4[Ni(OH)6] K4[Fe(CN)6] K2[HgI4] Н2[SiF6 ] |
3. За знаком заряду комплексного йона розрізняють:
катіонні комплекси [Cr(NH3)6]Cl3;
аніонні комплекси Na4[Ni(OH)6];
нейтральні комплекси [Co(NH3)3Cl3];
бікомплекси, які мають комплексний катіон і комплексний аніон
[Cr(NH3)6][Fe(CN)6].
4. За структурою внутрішньої сфери:
а) за кількістю комплексоутворювачів розрізняють моноядерні і поліядерні комплексні сполуки (H2[O3Cr-O-CrO3] - дихромова кислота);
б) за дентатністю лігандів – моно- і полідентатні.
5. Інші типи координаційних сполук
Циклiчнi комплекси. Якщо з комплексоутворювачем координуються бiдентатнi лiганди, то внаслiдок цього утворюються циклiчнi комплекси. У таких комплексах лiганд разом з комплексоутворювачем утворює замкнений цикл за рахунок координаційних звʼязків, наприклад, у сполуцi (а), змiшаних звʼязкiв, як у сполуцi (б) або суто йонного звʼязку, як в купрум оксалатi (в).
 |
У комплексi йона Cu(II) з глiцином − Cu(Gly)2 (б) (таблиця амінокислот надана в цінкі лекції) лiганд сполучений з комплексоутворювачем донорно-акцепторним та йонним звʼязками. Комплекси такого типу називають внутрiшньокомплексиними сполуками, або хелатами.
Структура цих сполук нагадує рака, якими молекули деяких органічних сполук нiби захоплюють йони металiв. Хелатнi комплекси утворюються при взаємодiї йонiв металiв з амiнокарбоновими кислотами та їx похiдними, а також з порфiриновим та кориновим циклами. Такi сполуки мають велике бiологiчне значения.
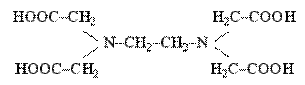 Полiдентатнi лiганди, до яких належать полiамiнокарбоновi кислоти називають комплексонами. Важливими комплексонами е нiтрилацетатна кислота (НТА) та етилендiамiнотетраацетатна кислота (ЕДТА):
Полiдентатнi лiганди, до яких належать полiамiнокарбоновi кислоти називають комплексонами. Важливими комплексонами е нiтрилацетатна кислота (НТА) та етилендiамiнотетраацетатна кислота (ЕДТА):
COOHCH2 − N − CH2COOH
 |
CH2COOH
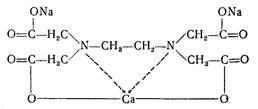 |
Найбiльше значения мають солi ЕДТА, зокрема натрiева сiлъ цiєї кислоти Nа2ЕДТА, або трилон Б, яка знаходить застосування в аналiтичнiй хімії та в медичнiй практицi при отруєннi сполуками Кальцiю (СаС2, Са(ОН)2, СаО) та iнших металiв. Наприклад, трилон Б звʼязуючи йони Кальцiю, перетворюється на тетацин Nа2СаЕДТА:
Комплексони використовують для пiдтримування метало-лiгандного гомеостазу, а також виведення йонiв токсичних металiв з органiзму.
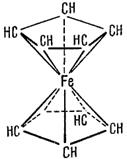 Сполуки, в яких атом металу розмiщений мiж двома органiчними молекулами циклiчної будови, називають сендвiчевими комплексами, наприклад, фероцен Fе(С5Н5)2:
Сполуки, в яких атом металу розмiщений мiж двома органiчними молекулами циклiчної будови, називають сендвiчевими комплексами, наприклад, фероцен Fе(С5Н5)2:
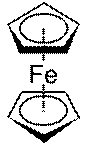 |
В утвореннi звʼязкiв у цих сполуках беруть участь вiльнi АО d-елементiв i система делокалiзованих π-орбiталей лiганду. Тому такi комплекси iнакше називають π-комплексами перехiдних металiв. Деякi сендвiчевi комплекси використовують як лiкарськi засоби.
Дата добавления: 2016-11-28; просмотров: 1231;
