Будова комплексних сполук
Будова комплексів пояснюється з позицій методів валентних звʼязків, молекулярних орбіталей, теорії кристалічного поля.
Розглянути будову комплексу [Cu(NH3)4]2– з позицій методу валентних звязків.
Комплексоутворювач Cu2+ має таку електронну конфігурацію валентного рівня: [Cu2+] = 3d94s04р0
Сu 2+ мають чотири вакантні орбіталі – одну 4s і три - 4р. Вони є акцепторами електронів.
 | |||||||
 |  | ||||||
 |



3d 4s 4p
Ці електронні орбіталі гібридизуються (відбувається sp3-гібридизація), причому утворюється тетраедричний комплексний іон.
Молекула амоніаку має одну неподілену пару електронів і є донором електронів:
. .
Н : N : Н.
Н
При взаємодії Сu2+ з чотирма молекулами амоніаку виникають чотири донорно-акцепторні зв’язки і утворюється комплексна сполука, електронну конфігурацію якої згідно з теорією валентних зв’язків можна зобразити таким чином:
 |
3d sp3
Тут електрони, які належали іону Сu2+, показані суцільними стрілками, а ті, які належали молекулам амоніаку, – пунктирними.
Гiбридизацiя − це процес утворення з атомних орбiталей рiзної · cuмeтpiї орбiталей однакової геометричної форми, рiвноцiнних за енергiєю. Вiдомо, що тип гiбридизацii АО визначається формою орбiталей, якi беругь участь у цьому процесi, та ix числом. Так, за учасnо s i р-орбiталей можливi три типи гiбридизацй; sp- , sp2-, sр3-гiбридизацiя, а за участю d-орбiталей – sp2d-, d2sp3-, sp3d2-гiбридизацiї та iн.
Для встановлення типу гiбридизацiУ АО i властивостей утворених сполук розrлянемо механізм утворення комплексних іонів на прикладі [Co(NH3)6]3+ та [CoF6]3−.
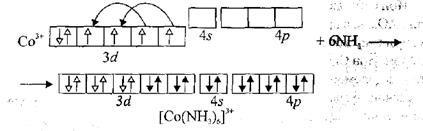 |
Електронна конфirурацiя основного стану атома Кобальту 3d74s2, а тривалентного йона Со3+ − 3d6. У процесi комплексоутворення атоми Нiтрогсну молекул NH3 (донори) вiддають свої вiльнi електроннi пари акцептору − йону Co(III). Але для того щоб цi шiсть пар електронiв змогли розмiститись навколо йона Со3+, на його орбiталях вiдбувається перегрупування електронiв таким чином, що два d-електрони спарюються, звiльняючи двi d-орбiталi на 3d-пiдрiвнi. Вiльнi мiсця на 3d-, 4s-, 4р-пiдрiвнях займають шiсть пар електронiв атомiв Нiтрогену молекул NH3, як показано на схемi:
Отже, за рахунок d2sp3-гiбридизацiї АО йона Со3+ утворилось шiсть рiвноцiнннх звʼязкiв центрального атома з лiгандами, спрямованих у просторi до вершин октаедра. Крiм того, всi електрони цього комплексного йона є спареними, тому вiн матиме дiамагнiтнi властивостi й належить до низькоспiнових комплексiв.
В аніоні [СоF6]3− комплексоутворювач Со3+ не мiстить на d-пiдрiвні електронних пар, а його вiльнi АО займають шiсть йонiв F−, якi мають вільнi пари електронів. Ці йони займають одну 4s-, три 4р- i дві 4d-орбiталi зовнiшнього енергетичного рiвня. Тому такий тип гiбридизації називають sр3d2-гiбридизацією, причому утворений комплексний йон має октаедричну будову. Вiн буде належати до високоспiнових комплексiв, що мають парамагнiтнi властивості.
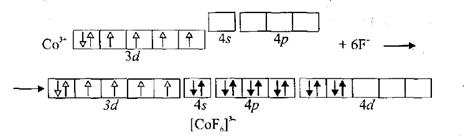 |
Утворення комплексного йона [СоF6]3− зображено на схемi:
Дата добавления: 2016-11-28; просмотров: 1446;
