ТОК на аноде на катоде 8 страница
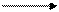 на аноде: 2O2- - 4ē O2
на аноде: 2O2- - 4ē O2
На получение lm алюминия расходуется 2 m A12O3, 60 кг криолита, 40 кг анодного угля, около 20000кВт электроэнергии.
в) физические и химические свойства
Алюминий - серебристо-белый металл, легкий, прочный. Плотность его 2,7 г/см3, почтив три раза легче железа. Не имеет характерного металлического блеска, так как покрыт тончайшей пленкой оксида А12O3. хорошо подвергается обработке: прокатывается, куется, штампуется, вытягивается в проволоку, обладает хорошей электрической проводимостью (после меди, серебра и золота - лучший проводник теплоты и электричества).
Алюминий химически активен, но на воздухе покрывается тончайшей (5 -10 нм) оксидной пленкой, надежно защищающей металл от дальнейшего окисления. Именно вследствие электрической и механической прочной защитной пленки при обычных условиях А1 ведет себя довольно инертно. При t плавления алюминия 660 °С гранулированный А1 не сплавляется в слиток даже при нагреве до 1200 °С, так как каждая капля расплава металла оказывается как бы в мешке из оксида. По этому почти все реакции с участием алюминия идущие с латентным периодом, необходимым для разрушения оксидной пленки или диффузии реагента через нее.
Взаимодействие с простыми веществами. При обычной температуре А1 взаимодействует с кислородом, образуя оксид 4А1 + 3O2 = 2Al2O3
При сильном нагревании порошок алюминия воспламеняется и стирает ослепительным белым пламенем, образуя оксид.
С пниктогенами (N3P) и халькогенами А1 взаимодействует при высокой температуре (700 - 2000 °С)
t°
2А1 + N2=A1N нитрид алюминия
t°
2А1 + 3S =A12S3 сульфид алюминия
С галогенами, за исключением йода, А1 реагирует при комнатной температуре.
2А1 + 3С12=2А1С13
2А1 + 3Вr2=2А1Вr3
В присутствии воды как катализатора А1 легко реагирует и с подом.
При взаимодействии А1 с углем при t = 1800° - 2000° Св атмосфере водорода происходит реакция синтеза карбида алюминия Аl4С3 в виде бесцветных прозрачных ромбоэдрических кристаллов. Примеси окрашивают его в желтый цвет.
t°
4А1 + 3C= А14С3
Галогены и халькогены вытесняют из карбида алюминия углерод. Получен карбид состава А12С6 (ацеленид).
Взаимодействие со сложными веществами. С водой А1 при обычных условиях не взаимодействует. Если в отсутствие воздуха удалить с поверхности метала пленку, то он активно реагирует с водой.
2Al + 6H2O = 3H2↑ +2А1(ОН)3↓
Алюминий взаимодействует с водными растворами щелочей. 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
Этот процесс протекает по стадиям: растворение защитной пленки
1. Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
Взаимодействие аммония с водой
2. 2А1 + 6Н2O=3Н2+2А1(ОН)3↑
Взаимодействие образовавшегося амфотерного гидроксида со щелочью
3. Al(OH)3+NaOH = Na[Al(OH3)]
Взаимодействие с кислотами.
В зависимости от типа и концентрации кислоты реакции протекают по-разному. Отличительной особенностью алюминия является его пассивация в холодных концентрированных азотной и серной кислотах.
Алюминий растворяется в разбавленных кислотах:
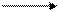 2А1 + 6НС1 2А1С13+3H2 ↑
2А1 + 6НС1 2А1С13+3H2 ↑
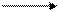 2A1+3H2SO4 A12(SO4)3 + 3H2 ↑
2A1+3H2SO4 A12(SO4)3 + 3H2 ↑
A1+4HNO3 =Al(NO3)3+NO↑+2H2O
Алюминий с концентрированной H2SO4 при обычной температуре не реагирует, при нагревании происходит реакция:
t°
8A1+15H2SO4 k=A12(SO4)3+3H2S ↑ + 12H2O или
t°
2А1 + 6H2SO4к = A12(SO4)3 + 3SO2 + 6H2O
t°
Al + HNO3 К0НЦ. = Al(NO)3 + 3NO2 ↑+ 3H2
Алюминий легко отнимает кислород у оксидов других металлов. Реакция взаимодействия алюминии с оксидами металлов сопровождается выделением большого количества теплоты.
Сr2О3 + 2Аl=2Сr + А12О3
3Мn3O4 + 8Al = 9Мn + 4А12O3
Процесс восстановления металлов из их оксидов алюминием называется алюмотермией. Этим способом получают некоторые щелочные и щелочноземельные металлы - барий, кальций, литий, рубидий, цезий; а также трудно восстанавливаемые, тугоплавкие металлы (титан, вольфрам, молибден, цирконий, ванадий).
Оксид и гидроксид алюминия.
А12О3 - оксид алюминия (глинозем), встречается в природе в кристаллическом виде, образует минерал корунд, обладающий высокой твердостью. Его прозрачные кристаллы, представляют драгоценные камни -рубин и сапфир.
А1(ОН)3 - гидроксид, твердое венество белого цвета.
А12Oз и А1(ОН)3 - имеют амфотерный характер.
Алюминиевая кислота Н3А1O3 теряет молекулу волы и превращается в метаалюминевую кислоту НА1O2,которая при диссоциации образует метаалюминат - анион А1O2
Алюминий образует два типа солей: средние с анионами различных кислот А1С13 - хлорид амония; А1(NO3)3 ─ нитрат алюминия и т.д.
• в виде аниона А1O2- ─ образует соли с катионами активных металлов -метаалюминаты. Эти соли в водных растворах существуют в виде устойчивых комплексов с молекулами воды - гидроксоалюминатов:
 +2H2O
+2H2O
NaA1O2 Na[Al(OH).4]
+2Н2O
 КА1O2 К[А1(ОН)4]
КА1O2 К[А1(ОН)4]
 +4H2O
+4H2O
Ва(А1О2)2 Ва[А1(OH4]2-
Соли первого типа образуются при взаимодействии оксида и гидрооксида алюминия с кислотами:
А12O3 + 6НСl = 2А1С13 + ЗН2O
Al2O3 + 6H+ = 2Al3+ + 3H2O
А1(ОН)3 + 3HCl= А1С13 + 3Н2O
А1(ОН)3 + 3H+= А13+ + 3Н2O
Соли второго типа образуются при взаимодействии оксида и гидроксида алюминия со щелочами:
а) в водных растворах щелочей образуются гидроксоалюминаты
А12 O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
А12O3 + 2OH- + 3H2O = 2[А1(ОН)4]-
б) при сплавлении образуется метаалюминаты:
А12O3 + 2NaOH= 2NaA1O2 + Н2O
А1(ОН)3 + NaOH= NaA1O2 + 2Н2O
Гидроксид алюминия получают в виде белого студенистого осадка при взаимодействии щелочей с растворимыми солями А13+
AlCl3 + 3NaOH=3NaCl + Al (OH)3
А13+ + 3OH-=А1(ОН)3↓
При проведении реакции следует избегать избытка щелочи, т.к.
амфотерный гидроксид алюминия растворяется в щелочах.
Гидроксид алюминия можно получить также из гидроксоалюминатов,
действуя на них сильными кислотам:
Na[Al(OH)4] + НС1 = Al(OH)3↓+NaCl + H2O
[А1(ОН)4]- + Н + = Аl(ОН)3↓ + Н2O
В избытке НС1 полученный осадок легко растворяется.
Соли в водных растворах сильно гидролизуются по катиону:
 ALC13 + H2O AlОНС12 + Hс1
ALC13 + H2O AlОНС12 + Hс1
 AL3+ + H2O A1OH2+ + H+
AL3+ + H2O A1OH2+ + H+
В сильно разбавленных растворах c течением времени гидролиз приводит к выпадению не только основных солей, но и гидроксида алюминия.
Метаалюминаты и гидроксоалюминаты в водных растворах также сильно гидролизуются, гидролиз идет по аниону;

 A1O2-+2H2OА1(ОH)3↓ + ОН-
A1O2-+2H2OА1(ОH)3↓ + ОН-
Водные растворы солей Al3+ и алюминатов имеют разный характер среды: первые - кислотный, вторые щелочной.
г) медико-биологическое значение алюминияи бора.
А1 - незаменимый микроэлемент в организме (10-5%). Концентрируется
главным образом в сыворотке крови,легких, печени, костях, почках, ноггях,
волосах, входит в структуру нервных оболочек мозга человека. Суточное
потребление алюминия человеком составляет 47мг. Алюминий влияет на
развитие эпителиальной и соединительной тканей, на регенерацию костных тканей, на обмен фосфора.
Алюминий воздействует на ферментативные процессы. В большинстве
случаев катион А13+ замещает ионы Э2+- активаторы ферментов, например
ионы Mg2+ и Са2+. Такая взаимозамещамость возможно вследствие сходства
ряда свойств ионов Al3+ и Mg2+, Сa2+ (ионы Al3+ и Mg2+ имеют близкие радиусы,
одинаковые координационные числа — 6: ионы А13+ и Саг+ имеют близкие энергии ионизации, одинаково координационные числа.
Избыток алюминия в организме тормозит синтез гемоглобина, т.к. благодаря довольно высокой комплексообразующей способности алюминия блокирует активные центры ферментов, участвующих в кроветворении. Имеются данные, что алюминий может катализировать реакцию трансаминирования, т.е. перенос NH2— группы.
Бор относится к примесным микроэлементам, его массовая доля в организме человека составляет 10-5%. Бор концентрируется в легких, щитовидной железе, селезенке, печени, мозге, почках, сердечной мышце. Бор входит в состав зубов и костей в виде труднорастворимых солей борной кислоты с катионами металлов.
Избыток бора вреден для организма человека. Имеются данные, что большой избыток бора угнетает амилазы, протеиназы, уменьшает активность адреналина. Предполагается, что снижение активности адреналина связано с его взаимодействием с ортоборной кислотой.
Исследования последних лет показали, что бор является необходимым элементом для животного организма, т.к. он участвует в углеродно-фосфатном обмене, взаимодействует с рядом биологически активных соединений (углеводами, ферментами, витаминами, гормонами). Вместе с тем, употребление пищевых продуктов с большим содержанием бора нарушает в организме обмен углеводов и белков, что приводит к возникновению эндемических заболеваний - энтеритов.
Вопросы для самоконтроля.
1. Начертите схемы расположения электронов по орбиталям и ячейкам у атома бора и атома алюминия.
2. Какие химические свойства характерны для бора?
3. Какие кислоты образует бор? Напишите молекулярные и структурные формулы.
4. Что такое бораны, бориты? Приведите примеры.
5. Как получить хром из оксида хрома (III) алюмотермическим методом?
6. С какими из следующих веществ будет взаимодействовать алюминий: NaOH, H2SO4 (конц. горячая), HNO3 (холодная, конц.), H2O (горячая)?
Напишите соответствующие уравнения реакций.
7. При взаимодействии сплава алюминия с медью, массой 6г с КОН выделился газ объемом 4,7 л (н.у.). Определите массовую долю (%) компонентов смеси. Ответ: 49,5% А1; 50,5% Сu
8. На поверхности алюминиевой пластины от долгого хранения образовался налет оксида и гидроксида алюминия. Как удалить этот налет химическим путем?
9. Как изменится окраска индикатора лакмуса в растворах: ALC13, А1(СН3СОО)3, NaAl(SО4)2
10.Осуществите цикл превращений:
 А12O3 AlC13 NaA1O2 А1(ОН)3 Al2(SO4)3 А1С13
А12O3 AlC13 NaA1O2 А1(ОН)3 Al2(SO4)3 А1С13
Лекция №25.
Тема: Общая характеристика металлов II группы главной подгруппы периодической системы Д.И. Менделеева. Щелочноземельные металлы.
План
1. Общая характеристика металлов II группы. Щелочноземельные металлы.
2. Щелочноземельные металлы, их получение и химические свойства.
3. Свойства магния и его соединений
4. Жесткость воды и способы ее устранения.
5. Биологическая роль s-элементов И А-группы. Их применение в медицине.
1. Общая характеристика металлов II группы. Щелочноземельные металлы.
Во II группу входят бериллий, магний и щелочноземельные металлы: кальций,
стронций, барий, радий. Макроэлементы – магний и кальций, стронций и барий. Магний входит в состав многих ферментативных систем; кальций - главный компонент костной ткани; стронций оказывает влияние на процессы в костной ткани, а барий играет определенную роль в функционировании органов зрения. В живых организмах эти элементы находятся в степени окисления +2.
Атомы этих элементов имеют по два валентных электрона на s-подуровне внешнего энергетического уровня (ns). В нормальном состоянии у атомов этих элементов нет неспаренных электронов, но при переходе атомов в возбужденном состоянии один s-валентных электронов переходит на р-подуровень, что и обусловливает проявление степени окисления +2. Например, атом магния в возбужденном состоянии имеет электронную формулу:
| ↑ | ||||||||
| ↑ | 3p1 | |||||||
| ↑↓ | ↑↓ | ↑↓ | 3s1 | |||||
| ↑↓ | 2p6 | |||||||
| ↑↓ | 2s2 | |||||||
| 1s2 |
Степень окисления больше +2 не проявляется
Число валентных электронов у атомов s-элементов II А-группы одинаково, но свойства магния и в особенности бериллия существенно отличаются от свойств щелочно-земельных металлов, что обусловлено значительным различием радиусов их атомов и ионов. Отличие свойств бериллия связано с тем, что его валентным электронам предшествует двух-электронная оболочка. Причиной различия в свойствах от свойств щелочноземельных металлов является и то, что кальций, стронций и барий имеют свободные d-орбитали, близкие по энергии к ns-орбиталям.
Бериллий во многом сходен с алюминием (диагональное сходство в периодической системе). Радиус атома и иона бериллия значительно меньше в сравнении с другими s-элементами группы, соответственно энергия ионизации атома бериллия выше, чем у остальных s-элементов II группы. В отличие от магния и щелочноземельных металлов бериллий является амфотерным элементом. В обычных условиях бериллий образует комплексные ионы. Способность иона бериллия образовывать более прочные комплексы по сравнению с ионами магния с кислородосодержащими лигандами, фторидами и другими, присутствующими в живых организмах, обуславливает токсическое действие этого катиона (Be2+ подавляет активность ферментов, активируемых ионом Mg2+; высокопрочные комплексы бериллия с фосфатами хорошо растворимы по сравнению с менее прочными магния, в результате введений в организм бериллий выводит из организмов в виде прочного комплекса фосфор, это приводит к уменьшению содержания кальция в организме). Магний и бериллий - антагонисты, т.е. добавление одного приводит к вытеснению другого.
Наиболее распространенными в природе являются кальций и магний; входят в состав минералов земной коры: СаСО3 - известняк, мел, мрамор; MgCO3 - магнезит; MgCO3 • СаСO3 - доломит, Са3(РO4)2 - фосфорит; CaSO4 ·2Н2O - гипс; MgSO4 · 7Н2O - горькая (английская) соль. Кальций и магний распространены в гидросфере и биосфере.
2. Щелочноземельные металлы, их получение и химические свойства.
Металлы главной подгруппы II группы получают из расплавов их солей путем электролиза:
МеС12 = Ме2+ + 2Сl-
 Эл-з
Эл-з
 Ме2+ + 2ē Ме° MeCl2 = Me + Cl2↑
Ме2+ + 2ē Ме° MeCl2 = Me + Cl2↑
 2С1- -2ē С12
2С1- -2ē С12
Катод (-)
Анод (+)
Химические свойства щелочноземельных металлов.
Эти металлы, как и щелочные, отличаются высокой химической активностью, связанной с их сильной восстановительной способностью.
Рассмотрим типичные химические реакции на примере кальция. Взаимодействие с неметаллами:
2 -2
2Са + O2 = 2СаО оксид кальция
+2 -1
Са + Сl2 = СаСl2 хлорид кальция
+2 -2
Cа + S = CaS сульфид кальция
+2 -3
3Са + N2 = Ca3N2 нитрид кальция
2 -3
3Са + 2Р = Са3Р2 фосфид кальция
+2 -1
Са + Н2 = СаН2 гидрид кальция
Во всех реакциях Са как восстановитель отдает 2ē и превращается в ион Са +. Атомы неметаллов принимают то количество электронов, которое им необходимо для завершения внешнего слоя.
Взаимодействие с водой.
Кальций, стронций, барий (щелочноземельные металлы) активно взаимодействуют с водой, вытесняя из нее водород и образуя соответствующие щелочи. Например:
Са + 2Н2O = Са(ОН)2 + Н2↑
Взаимодействие с разбавленными кислотами.
Са + H2SO4 = CaSO4 + H2↑
Фактически реакция идет в две стадии:
Са + 2Н2O = Са(ОН)2 + Н2↑
Са(ОН)2 + H2SO4 = CaSO4 + 2H2O
Важнейшие соединения щелочноземельных металлов.
Оксиды.
Общая формула МеО. Твердые тугоплавкие вещества белого цвета, хорошо растворимые в воде. По химическим свойствам представляют собой типичные основные оксиды и проявляют общие свойства этого класса соединений:
t0
CaO + CO2 = СаСО3
СаО + H2SO4 = CaSO4 + H2O
В отличие от многих других основных оксидов, но так же, как оксиды щелочных металлов, взаимодействуют с водой с образованием щелочей:
СаО (негашеная известь) + Н2O = Са(ОН)2 (гашеная известь)
Наибольшее практическое применение имеет оксид кальция, имеющий технические названия: «негашеная известь», «жженая известь».
Гидроксиды.
Общая формула Me (OH)2. по физическим свойствам - твердые кристаллические вещества белого цвета, при нагревании разлагаются на основной оксид и воду:
Са(ОН)2 = СаО + Н2O
В ряду Са(ОН)2 →Sr(OH)2 → Ва(ОН)2 растворимость в воде существенно увеличивается. Насыщенные водные растворы Са(ОН)2 называют «известковой водой», а Ва(ОН)2 - «баритовой водой».
По химическим свойствам гидроксиды щелочноземельных металлов являются сильными основаниями, поэтому легко реагируют с кислотными оксидами, кислотами и некоторыми солями:
Ва(ОН)2 + СO2 = ВаСО3 ¯ + Н2O
Ва(ОН)2 + H2SO4 = BaSO4¯ + 2H2O
Ва(ОН)2 + СuСl2 = Cu(OH)2 ¯ + ВаСl2
Наибольший практический интерес представляет гидроксид кальция Са(ОН)2 (в технике - «гашеная известь»). Смесь гашеной извести с песком и водой называется известковым раствором, который широко используется в строительном деле.
Затвердение известкового раствора происходит сначала из-за испарения воды, а затем в результате поглощения из воздуха углекислого газа и образования карбоната кальция:
Са(ОН)2 + СO2 = СаСо3¯ + Н2O
Эта химическая реакция является также причиной помутнения «известковой» воды на воздухе.
Из наиболее важных солей щелочноземельных металлов растворимыми в воде
являются хлориды и нитраты. Все соли представляют собой типично ионные
соединения с кристаллической структурой и высокими температурами кипения и
плавления. Некоторые из них при нагревании разлагаются на соответствующие
оксиды: t
СаСО3 = СаО + СO2↑
Это свойство очень важно, т.к. позволяет из природных карбонатов получать оксиды металлов, а затем на их основе и другие необходимые химические соединения.
Важным химическим свойством карбоната кальция является его способность под воздействием воды и углекислого газа переходить в гидрокарбонат, который в воде достаточно хорошо растворяется:
СаСО3 + СO2 + Н2O = Са(НСO3)2
Этот процесс широко осуществляется в природных условиях, приводя к выбросу размываемых известняков в поверхностные воды, а затем - в моря и океаны.
Соли щелочноземельных металлов окрашивают бесцветное пламя горелки в различные цвета:
Са2+- кирпично-красный;
Sr2+ - карминово-красный;
Ва2+ - зеленовато-желтый.
3. Свойства магния и его соединений.
Магний не входит в группу щелочноземельных металлов. Основной причиной этого является нерастворимость в воде его оксида MgO и гидроксида Mg(OH)2. Вследствие этого и сам магний очень медленно, только при длительном нагревании взаимодействует с водой:
Mg + 2Н2O = Mg(OH)2 + Н2↑
Магний - очень активный восстановитель, в электрохимическом ряду напряжений стоит сразу за щелочными и щелочноземельными металлами. Исключая взаимодействие с водой, он проявляет химические свойства, сходные с кальцием: сгорает на воздухе с образованием MgO, реагирует со всеми неметаллами (причем очень легко образует нитрид Mg3N2), растворяется в кислотах с вытеснением водорода.
Главные области применения металлического магния:
1. приготовление на его основе различных легких сплавов, используемых в ракетной технике, авиа- и приборостроении;
2. применение в металлургии для получения некоторых ценных металлов (магнийтермия);
3. изготовление осветительных и зажигательных ракет.
Оксид и гидроксид магния обладают выраженным основным новым характером и проявляют все типичные свойства основных оксидов и оснований.
MgO (жженая магнезия) получается в промышленности путем прокаливания природного магнезита MgCO3. Имеет очень высокую температуру плавления (≈3000°С) и применяется для изготовления огнеупорных материалов.
Mg(OH)2 получают при действии щелочей на растворимые соли магния:
MgCl2 + 2NaOH = Mg(OH)2¯(белый осадок) + 2NaCl
Соли магния во многом сходны с солями кальция. Природный MgCO3 переходит под воздействием влаги СO2 в растворимый в воде гидрокарбонат магния:
MgCO3 + Н2O + СO2 = Mg(HCO3)2
В отличие от солей кальция соли магния гидролизуются в водных растворах:
 MgCl2 + H2O MgOHCl + HCl
MgCl2 + H2O MgOHCl + HCl
Mg2+ + H2O MgOH+ + H+
4. Жесткость воды и способы ее устранения.
В земной коре кальций и магний находятся в виде солей: карбонатов, сульфатов, фосфатов. Находящийся в воздухе оксид углерода (IV) (СO2) растворяется в дождевой воде, которая, проходя через слой почвы, переводит в растворимое состояние находящиеся в ней соли кальция и магния. Сульфаты и хлориды растворяются непосредственно, а нерастворимые карбонаты переходят в раствор в виде кислых солей - гидрокарбонатов и переносятся подземными и речными водами на большие расстояния.
СаСОз + Н2O + СO2 = Са(НСO3)2
СаСОз + Н2O + СO2 = Са2+ + 2НСO3-
MgCO3 + Н2O + СO2 = Mg(HCO3)2
MgCO3 + Н2O + СO2 = Mg2+ + 2НСО3-
В результате вымывания солей кальция образуются пещеры. За счет испарения воды или повышения температуры могут образовываться отложение карбоната кальция (например, образование сталактитов и сталагмитов в пещерах).
Природная вода, содержащая значительные количества растворенных солей кальция и магния, называется жесткой водой. Жесткая вода имеет низкие вкусовые качества, а длительное употребление ее приводит к возникновению почечно-каменой болезни.
Жесткость воды - это совокупность таких свойств, которые придают воде ионы Са2+ и Mg2+.
Различают временную и постоянную жесткость воды. Временную жесткость, вызванную наличием гидрокарбонатов кальция и магния, можно устранить кипячением:
Дата добавления: 2016-11-22; просмотров: 1015;
