ТОК на аноде на катоде 7 страница
 Na2CO3 + H2O NaHCO3 + NaOH
Na2CO3 + H2O NaHCO3 + NaOH
Вследствие гидролиза водные растворы карбонатов имеют щелочную реакцию. Это важное обстоятельство используется на практике. Для нейтрализации промышленных кислых сточных вод - используют Na2CO3 (кристаллическую соду). При попадании кислоты на кожу или в глаза после промывания водой проводят мягкую нейтрализацию раствором питьевой соды (NaHCO3). Эту же соль применяют для нейтрализации избыточной кислотности желудочного сока.
Сода Na2CO3 - один из важных продуктов химической промышленности. Эту соль можно получить двумя способами.
Взаимодействие щелочи с углекислым газом:
2NaOH + СO2 = Na2CO3 + Н2O
 Аммиачно-хлоридный способ осуществляется по схеме:
Аммиачно-хлоридный способ осуществляется по схеме:
+ СO2 NaCl t°
NH3 + H2O NH4HCO3 NaHCO3 Na2CO3
Качественной реакцией для определения анионов СO32- является взаимодействие карбонатов и гидрокарбонатов с растворами сильных кислот:
Na2CO3 + 2НС1 = 2NaCl + H2O + СO2↑
СO32- + 2Н+ = Н2O + СO2↑
Чтобы убедиться в том, что выделяющийся газ - СO2, его пропускают через известковую воду, которая мутнеет вследствие образования осадка СаСO3:
СO2 + Са(ОН)2 = СаСO3↓ + Н2O
При пропускании избытка СO2 выпавший осадок СаСO3 растворяется, так как превращается в растворимый гидрокарбонат кальция:
СаСО3 + СO2 + Н2O = Са(НСO3)2
Последние две реакции могут рассматриваться как качественные реакции на углекислый газ.
6. Кремний и его соединения.
Кремний является аналогом углерода.
Электронная конфигурация атома кремния: Is2 2s2 2p6 3s2 3р2. Строение внешнего электронного слоя:
| ↑ | ↑ | ||
| ↑↓ | 3p2 | ||
| 3s2 |
Кремний является неметаллом и проявляет в своих соединениях и положительные, и отрицательные степени окисления, наиболее характерными являются следующие:
-4(рилан SiH4, силициды металлов Mg2Si, Ca2Si и др.);
О (простое вещество Si)
+4 (оксид кремния (IV), кремниевая кислота H2SiCO3 и ее соли - силикаты, галогениды кремния (IV) SiF4 и др.)
Наиболее устойчива для кремния степень окисления +4.
Кремний - один из самых распространенных в земной коре элементов (более 25% массы). Главная часть земной коры состоит из силикатных пород, представляющих собой соединения кремния с кислородом. Природные силикаты - это соединения нескольких оксидов. Соединения, в состав которых входит оксид алюминия, называются алюмосиликатами. Таковы: белая глина А12O3 · 2SiO2 • 2Н2O, полевой шпат К2O • А12O3 • 6SiO2, слюда К2O • А12O3 • 6SiO2 •Н2O.
Многие природные силикаты в чистом виде являются драгоценными камнями, например, аквамарин, изумруд, топаз и другие.
Значительная часть природного кремния представлена оксидом кремния (IV) SiO2. Свободного SiO2 в земной коре около 12%, в виде горных пород 43%. В общей сложности более 50% земной коры состоит из оксида кремния (IV).
Очень чистый кристаллический SiO2 известен в виде минералов горного хрусталя и кварца.
Оксид кремния (IV), окрашенный различными примесями, образует драгоценные и полудрагоценные камни - агат, аметист, яшму. В свободном виде кремний в природе не встречается.
Получение. В промышленности для получения кремния используют чистый песок SiO2.
t°
SiO2 + 2С = Si + 2СО
В лаборатории в качестве восстановителей используют магний или алюминий:
t°
SiO2 + 2Mg = Si + 2MgO
t°
3SiO2+4Al = 3Si + 2Al2O3
Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом или цинком:
t°
SiCl4 + 2H2=Si + 4HCl
t°
SiCl4 + 2Zn = Si + 2ZnCl2
Аморфный кремний представляет собой бурый порошок с температурой плавления 1420 °С. Другая аллотропная модификация кремния - кристаллический кремний. Это твердое вещество темно-серого цвета со слабым металлическим блеском, обладает тепло- и электропроводностью. Кристаллический кремний получают перекристаллизацией аморфного кремния. Амфотерный кремний является более реакционноспособным, чем химически довольно инертный кристаллический кремний.
По химическим свойствам кремний во многом схож с углеродом, что объясняется одинаковой структурой внешнего электронного слоя. При обычных условиях кремний довольно инертен, что обусловлено прочностью его кристаллической решетки. Непосредственно при комнатной температуре он взаимодействует только с фтором. При температуре 400 - 600 °С кремний реагирует с хлором и бромом, а в кислороде измельченный кремний сгорает. С азотом и углеродом кремний реагирует при очень высоких температурах. Во всех указанных реакциях кремний играет роль восстановителя.
 +4 -1
+4 -1
Si0 + 2F2° = SiF4
+4 -1
Si° + 2C12° = SiCl4
+4 -1
Si° + 2Br2° = SiBr4
галогениды кремния
Галогениды кремния в воде легко гидролизуются с образованием кремниевой и галогенводородных кислот, например:
SiCl4 + 3H2O = H2SiO3 + 4HC1
+4 -2
Si + O2 = SiO2 оксид кремния (IV)
t0 +4 -3
3 Si0 + 2N2° = Si3N4 нитрид кремния
t0 +4 -4
Si° + С0 = SiC карбид кремния, или карборунд
Кремний как восстановитель взаимодействует с фтороводородом:
Si + 4HF = SiF4↑ + 2Н2↑
С другими галогеноводородами он в реакцию не вступает. На холоду кремний реагирует со смесью азотной и плавиковой (HF) кислот:
3Si + 12HF + 4HNO3 = 3SiF4↑ + 4NO↑ + 8Н2O
Остальные кислоты на кремний не действуют, так как в кислых растворах на поверхности кремния образуется плотная оксидная пленка (SiO2), которая растворяется только фтороводородной (плавиковой) кислотой.
Водные растворы щелочей растворяют кремний с образованием растворимых солей кремниевой кислоты - силикатов, при этом происходит выделение водорода:
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
При взаимодействии с металлами кремний как неметалл играет роль
окислителя. Соединения кремния с металлами, называются силицидами:
t0
Si + 2Mg = Mg2Si
При обработке силицида магний соляной кислотой или водой образуется простейшее водородное соединение кремния - силан SiH4:
Mg2Si + 4HC1 = 2MgCl2 + SiH4↑
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4↑
Силан - ядовитый газ с неприятным запахом, легко самовоспламеняется на воздухе:
SiH4 + 2O2 = SiO2 + 2Н2O
Оксид кремния (IV) Si02 (диоксид кремния, кремнезем, ангидрид кремниевой кислоты) - твердое тугоплавкое вещество (температура плавления 1713 °С), нерастворимое в воде; из всех кислот только фтороводородная кислота постепенно разлагает его:
SiO2 + 4HF = SiF4↑ + 2H2O
Как кислотный оксид SiO2 при нагревании или сплавлении реагирует с основными оксидами, щелочами и некоторыми солями (например, карбонатами)
с образованием кремниевой кислоты - силикатов). Например:
t0
SiO2 + Na2O = Na2SiO3
t0
SiO2 + 2NaOH = Na2SiO3 + H2O
Полученные искусственным путем силикаты натрия и калия - растворимое стекло - сильно гидролизованы. Их концентрированный раствор, называемый жидким стеклом, имеет сильнощелочную реакцию. Жидкое стекло применяется для изготовления несгораемых тканей, пропитки деревянных изделий, в качестве клея и т.д.
Кремниевая кислота H2SiO3 относится к очень слабым кислотам. В воде практически нерастворима, но легко образует коллоидные растворы. Ее можно получить из растворов силикатов действием на них более сильных кислот: соляной, серной, уксусной и даже угольной. H2SiCO3 выпадает из раствора в виде студенистого осадка:
K2SiO3 + 2HC1 = H2SiO3↓ + 2KC1
Na2SiO3 + H2O + СO2 = H2SiO3↓ + Na2CO3
Постепенно при обычных условиях или быстрее при нагревании кремниевая кислота разлагается на воду и ангидрид кремниевой кислоты SiO2:
H2SiO3 = H2O + SiO2
7. Биологическая роль углерода и кремния и применение их соединений в медицине.
По содержанию в организме человека (21,15%) углерод относится к макроэлементам, является основой всех органических соединений, это органоген номер один. Он входит в состав всех тканей и клеток в форме белков, жиров, углеводов, витаминов, гормонов. В организме гидрокарбонаты натрия и калия с угольной кислотой образуют буферную систему, участвующую в поддержании КОС (кислотно-основного состояния организма). Гидрокарбонат натрия применяется как антацидное (нейтрализующее) средство. Активированный уголь как адсорбирующее средство применяют при метеоризме, пищевых отравлений, а также при отравлениях алкалоидами.
Кремний по содержанию в организме человека относится к примесным микроэлементам (10-3%). Больше всего кремния в эпителиальной и соединительной тканях, в печени, надпочечниках, волосах и хрусталике глаза. В организм человека двуокись кремния попадает в основном воздушным путем через легкие в виде пылеобразного SiO2. С нарушением обмена кремния связывают возникновение гипертонии, ревматизма язвы, малокровия.
Недавно было установлено, что кремний содержится в коже, хрящах, связках млекопитающих и входит в состав мукополисахаридов, где прочно связан эфирными связями, возникающими при взаимодействии ортокремневой кислоты с гидроксильными группами углеводов. В составе биомолекул кремний связан только с атомами кислорода (Si - О), так как энергия этой связи существенно выше энергии связей Si - Н, Si - С, Si - S и т.д.
В медицине практически применяют карбид кремния (IV) - карборунд для шлифовки пломб и пластмассовых протезов.
Пыль, состоящая из части угля, диоксида кремния, аммония- при систематическом воздействии на легкие вызывает заболевание - пневмокониозы (при действии угольной пыли - антракоз; при вдыхании пыли, содержание SiO2 возникает силикоз; при действии алюминиевой пыли - алюминоз). При длительном контакте силикатных песчинок с биологическими жидкостями образуется гелеобразная поликремневая кислота, отложения которой в клетках ведет к их гибели.
Вопросы для самоподготовки.
1. Какие степени окисления проявляют элементы IV А группы?
2. Чем объясняются уникальные свойства углерода?
3. В двух цилиндрах содержится СО и СО2. Как химическим путем определить, какой газ находится в каждом цилиндре?
4. Как разлагаются карбонаты и гидрокарбонаты при нагревании?
5. Укажите положения кремния в периодической системе. Какие степени окисления характерны для кремния?
6. Напишите в молекулярной и ионной формах уравнения гидролиза NH4HCO3, К2СO3.
7. 


 Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: С СаС2 Са(ОН)2 СаСO3 СO2 ;
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: С СаС2 Са(ОН)2 СаСO3 СO2 ;

 СН4 СО2 СО Fe.
СН4 СО2 СО Fe.
8. Мрамор массой 15 г, содержащий 12% примесей, обработали избытком хлороводородной кислоты. Образовавшийся газ пропустили через раскаленный уголь (н.у.). Какой газ и в каком объеме при этом образовался?
9. Какую массу SiO2 можно восстановить коксом массой 7,5 г с примесями в 20%?
10.С какими из следующих веществ взаимодействует SiO2: H2O, КОН, СаСO3, С, MgO, HC1? Напишите соответствующие уравнения реакций?
Лекция №24
Тема: «Главная подгруппа III группы периодической системы Д.И. Менделеева.
Бор. Алюминий»
План
1.Общая характеристика элементов.
2.Бор и его соединения.
3.Алюминий;
а) особенности химии алюминия;
б) природные соединения и получение;
в) физические и химические свойства;
г) медико-биологическое значение алюминия и бора.
1. Общая характеристика элементов.
К главной подгруппе III группы относятся элементы: B - бор; А1 -алюминий; Ga - галлий; Jn,- индий; Т1 - талий. Строение внешнего электронного слоя ns2np1; электронно-графическая формула:
| ↑ | |||
| ↑↓ | np | ||
| ns |
| ↑ | 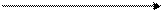 ↑ ↑
| ||
| ↑ | np | ||
| ns |
+E
основное возбужденное
состояние состояние
B=1 B=III (наиболее характерная валентность)
Они являются р - элементами, проявляют в соединениях высшую степень окисления (+3). За исключением бора, элементы этой подгруппы являются металлами. Оксиды типа Э2Oз и гидрооксиды Э (ОН)3.
С ростом заряда ядра и атомного радиуса происходит закономерное изменение свойств элементов: в подгруппе сверху вниз энергия ионизации уменьшается, восстановительная способность увеличивается => усиливаются металлические свойства. Закономерно изменяется и химический характер оксидов и гидрооксидов:
| В2O3 | А12O3 | Ga2O3 | Jn2Оз | Tl2O3 |
| Н3ВО3 | А1(ОН)3 | Ga(OH)3 | Jn(OH)3 | Т1(ОН)3 |
| кислотные свойства | амфотерные соединения с преобладанием основных свойств | основные свойства |
 усиление основных свойств
усиление основных свойств
2. Бор и его соединения.
Электронная формула атома бора 1s22s22p1. Наличие одного неспаренного электрона могло бы обусловить существование одновалентных соединений, что мало характерно для бора. Объясняется это тем, что один из спаренных 2s -электронов сравнительно легко промотируют на 2р - орбиталь и тогда бор функционирует как трехвалентный: дополнительно образующиеся две ковалентные связи дают большей внигрым в энергии. В соединениях бора химические связи малополярны; малые размеры атома, ионизационные потенциалы бора - все это вместе взятое определяет неметаллическую природу бора. В это же время по химической активности бор уступает следующим за ним элементам 2-го периода. Бор обнаруживает диагональную аналогию с кремнием. Для бора и кремния наиболее характерны производные, в которых эти элементы поляризованы положительно. Для обоих элементов их низшие гидриды малоустойчивы и газообразны. Много общего имеет химия кислородных соединений бора и кремния: кислотная природа оксидов и гидрооксидов, стеклообразование оксидов, способность образовывать многочисленные полимерные структуры и т.д.
Содержание бора в земной коре 3∙10-4%. В природе встречается исключительно в виде кислородных соединений: борной кислоты Н3ВО3; буры Na2B4O7 ∙ 10H2O и минерала ашарита MgHBO3. Для получения из природных соединений бор переводят в оксид В2O3, в галогениды или в бороводороды. Далее пользуются методами металлотермии:
3Mg+ В2O3= 3MgO + 2 В ∆G0298 = - 532,2 кДж
2ВС13 + 3Zn = 3ZnCl2 + 2В ∆G°298 = - 504,5 кДж
В этих процессах получатся аморфный бор, загрязненный примесями. Более чистый бор получается восстановлением его хлорида водородом или осаждением кристаллического бора на раскаленной проволоке из тантала или вольфрама.
Но более перспективны методы, основанные на пиролизе боранов: В2Н6=2В+3Н2
Кристаллы чистого бора серовато-черного цвета, отличаются тугоплавкостью и хрупкостью. По твердости он уступает только алмазу и кубическому нитриду бора.
При обычных условиях бор химически инертен. При высоких
температурах он взаимодействует с кислородом, хлором, серой, азотом.
Кипящие соляная и платиновая кислоты на него не действуют. Он медленно
реагирует с такими сильными окислителями как фтор, горячая
концентрированная азотная кислота и царская водка. Во всех случаях кристаллический бор химически менее активен, чем аморфный.
2В + 2NaOH + 2Н2O = 2NaBO2 + 3Н2
аморф. конц.
Отношения бора к простым веществам: при нагревании бор присоединяет металлы, образуя бориды
3 Mg + 2 В = Mg3B2 - борид магния Mg = В - Mg - В = Mg
С углеродом бор образует очень твердый карбид 4В + С = В4С
В В







 с
с
вв
Важное свойство карбида бора - поглощать нейтроны. Сам карбид бора, а также продукт, полученный путем прессования бора с порошком алюминия - бораль применяют в атомных реакторах для защиты от нейтронов. С кислородом бор взаимодействует при t° = 700 °С
4В + 3O2 = 2 В2O3 ∆Н= - 252 ккал/моль
Отношение бора к сложным веществам: концентрированные азотная и серная кислоты окисляют бор до борной кислоты.
В + 3HNO3(k) - Н3ВO3 + 3NO2
борная кислота
Бор растворяется в концентрированных щелочах
2В + 2NaOH + 2 Н2O = 2NaBO2+3H2↑
натриевая соль
метаборной кислоты.
Соединения бора.
С водородом бор образует много соединений, которые называются бороводородами или боранами.
Взаимодействие борида с кислотой
Mg3B2 + 6 НС1 = В2Н6 + 3 MgCl2
борэтан
По свойствам бораны имеют много общего с кремневодородами и углеводородами. Все бораны имеют характерный неприятный запах, очень токсичны: вдыхание их паров вызывает головную боль и рвоту. Химически бораны весь реакционноспособны и по отношению к большинству реагентов менее устойчивы, чем кремневодороды. Водой, щелочами, окислителями бораны разрушаются.
В2Н6 + 6Н2O= 2В(OН)2 + 6Н2
При нагревании бораны разлагаются; наименее устойчив тетраборан. Нагревание боранов выше 250 °С заканчивается полным их разложением на водород и бор.
Кислоты вытесняют из горячих растворов буры борную кислоту Na2B4O7+ H2SO4 + 5Н2O = 4Н3ВO3 + Na2SO4
Борная кислота слабая, следовательно, соли ее гидролизуются
 Na2B4O7 + 2 Н2O 2NaOH + Н2В4O7
Na2B4O7 + 2 Н2O 2NaOH + Н2В4O7
 Н2В4O7 + 5H2O 4Н3ВO3
Н2В4O7 + 5H2O 4Н3ВO3
 Na2B4O7 + 7H2O 4H3BO3 + 2NaOH
Na2B4O7 + 7H2O 4H3BO3 + 2NaOH
Растворы имеют сильнощелочную реакцию среды (рН~ 11)
Качественной реакцией на борную кислоту и буру является реакция с этиловым спиртом в присутствии концентрированной серной кислоты.
| С2Н5-ОН | Н-O | |
| С2Н5-ОН | + |   Н-O Н-O
|
| С2Н5-ОН | Н-O |
 O - С2H5
O - С2H5


 B B O -C2H5
B B O -C2H5
O– C2H5

+ 3H2O
борноэтиловый эфир
Образовавшийся борноэтиловый эфир В(ОС2Н5)3 окрашивает пламя в зеленый цвет.
Оксид бора В2O3 (борный ангидрид) получают сжиганием бора в кислороде или прокаливанием борной кислоты. Оксид бора - бесцветная, хрупкая стекловидная масса, плавящаяся при температуре 600°С.
Оксиду бора соответствует борная кислота Н3ВO3, которая при нагревании может терять воду, переходя в метаборную кислоту НВO2; а при прокаливании - в тетраборную Н2В4O7.
4НВO2
 Н3ВO3 НВO2 Н2В4O7 2В2O3
Н3ВO3 НВO2 Н2В4O7 2В2O3
-Н2O -Н2O -Н2O
Соли орто- и метаборной кислот неустойчивы; соли тетраборной кислоты - устойчивы. Соли борных кислот называются боратами. Бораты являются производными метаборной и тетраборной кислот. Применение - борная кислота применяется наружно как антисептическое средство в виде водных растворов (2 - 4%) для полоскания рта, зева и для промывания глаз; мазь (5 - 10%); в присыпках при заболеваниях кожи.
3. Алюминий.
а) особенности химии алюминия.
Второй типический элемент III группы периодической системы -алюминий - является первым и самым легким р - металлом с электронной формулой Is2 2s2 2p6 3s2 Зр1. У алюминия по сравнению с бором атомный радиус больше, а потенциалы ионизации меньше, следовательно, возрастают металлические свойства. В отличии от бора алюминий является амфотерным элементом: металлический алюминий и его гидроксид растворяются и в кислотах, и в щелочах, а А1(+3) образует и комплексные катионы, и ацидокомплексы. Для химии алюминия важное значение имеет его большое сродство к кислороду. Для алюминия наблюдаются горизонтальная аналогия со вторым типическим элементом IV группы - кремнием. Отчетливо проявляется она в алюмосиликатах, которые являются наиболее распространенными в земной коре химическими соединениями.
б) природные соединения и получение алюминия.
Алюминий - один из самых распространенных на Земле элементов (8,8%), занимает третье место по распространенности после кислорода и кремния. Помимо алюмосиликатов он встречается в природе в виде
KA1(SO4)2 · 2А1(ОН)3 (алунит), Na2[AlF6] (криолит), Mg[Al2O4] (шпинель), а также в виде оксида и его гидратных форм. Это, прежде всего корунд αА12O3. В зависимости от содержания примесей корунд имеет различную окраску и в соответствии с ней названия: бесцветный - лейкосапфир, голубой - сапфир, рубиново-красный - рубин. Из гидратных форм оксида алюминия отмечается > боксит А12O3∙n Н2O с примесями оксида кремния, железа, титана и т.д. В зависимости от минералогической формы боксита и содержания связанной воды различают гидраргиллит А12O3 ∙3Н2O и диаспор А12O3∙ 2Н2O. Боксит является наиболее ценной алюминиевой рудой, содержащей более 50% А12O3.
В промышленности металлический алюминий получают электролизом чистого А12O3 или очищенного боксита в расплавленном криолите Na3[AlF6], который нужен как растворитель оксида алюминия, а также для понижения температуры процесса (оксид алюминия плавится при 2050 С).
В электрической ванне температура плавления достигнет 950 - 1000 С. Кроме того, криолит и другие добавки (CaF2) снижают плотность электролита. При электролизе расплава А12O3 в криолите образуется:
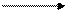 на катоде: А13+ + 3e А1
на катоде: А13+ + 3e А1
Дата добавления: 2016-11-22; просмотров: 935;
