ТОК на аноде на катоде 4 страница
Na2S2O3 + С12 + Н2O = S + Na2SO4 + 2HC1
 S2O32- + Н2O = S0 + SO42- + 2Н++ 2ē 1
S2O32- + Н2O = S0 + SO42- + 2Н++ 2ē 1
С120 + 2ē = 2С1- 1
Сильные кислоты вытесняют из тиосульфата натрия тиосерную кислоту, которая даже разлагается с образованием серы.
Na2S2O3 + 2HC1 = 2NaCl + H2S2O3
H2S2O3 = S↓ + SO2 + H2O
Натрий тиосульфат Na2S2O3 • 5Н2O применяют в медицинской практике как противотоксическое, противовоспалительное и десенсибилизирующее средство. Как противотоксическое средство, натрий тиосульфат используют при отравлениях соединениями ртути, свинца, синильной кислотой и ее солями. Механизм действия препарата связан с окислением тиосульфат-иона до сульфит-иона и элементарной серы:
S2O32-→SO32- + S
Ионы свинца и ртути, попадающие в организм с пищей или воздухом, образуют плохо растворимые нетоксичные сульфиты:
Pb2+ + SO32- = PbSO3↓
Цианид-ионы взаимодействуют с элементной серой, образуя менее ядовитые тиоцианаты:
CN- + S0 = NCS-
Применяют натрий тиосульфат и для лечения чесотки. После втирания в кожу раствора Na2S2O3 делают повторные втирания 6% -ного раствора НС1. В результате реакции с НС1 натрий тиосульфат распадается на серу и серу диоксид:
Na2S2O3 + 2НС1 = 2NaCl + SO2 + S↓ + Н2O
(сера и диоксид серы оказывают губительное действие на чесоточных клещей).
Вопросы для самоподготовки:
1. Охарактеризуйте кислотно-основные и окислительно-восстановительные свойства сероводородной кислоты.
2. Что является качественной реакцией на сероводородную кислоту и ее растворимые соли?
3. Почему диводород сульфит является токсичным соединением для живых организмов?
4. Расставьте методом электронного баланса коэффициенты в уравнении реакции: H2S + НС1O3 →H2SO4 + HCl
5. Какие кислородные соединения образует сера?
6. Какой возможет механизм противотоксического действия тиосульфата натрия при отравлении соединениями ртути, свинца, сильной кислотой.
7. Какие из перечисленных солей будут подвергаться гидролизу: ZnSO4, K2SO4, Na2SO3? Выразите первую стадию гидролиза в молекулярной и ионной формах.
8. При помощи каких реакций можно осуществить следующий цикл превращений: S→H2SO4→CuSO4→A12(SO4)3→Na2SO4→H2SO4
9. Напишите уравнения реакций растворения натрия, цинка, ртути в разбавленной и концентрированной серной кислоте?
10. Сколько и какого газа выделится при растворении 5,4 г серебра в 98%-ной серной кислоте (плотность 1,84 г/см3)? Сколько мл кислоты при этом израсходуется?
Лекция №21.
Тема: Главная подгруппа V группы. Общая характеристика. Строение атома, физические и химические свойства азота. Важнейшие соединения азота.
План
1. Общая характеристика элементов.
2. Азот и его свойства.
3. Аммиак. Соли аммиака.
4. Кислородные соединения азота.
5. Азотистая кислота.
6. Азотная кислота и ее соли.
1. Общая характеристика элементов.
Главную подгруппу V группы составляют р-элементы: азот N, фосфор Р, мышьяк As, сурьма Sb, висмут Bi. Атомы этих элементов имеют на внешнем энергетическом уровне по 5 электронов, из которых два спаренные на s-подуровнях, а три неспаренных на р-подуровнях:
| ↑ | ↑ | ↑ | |
| ↑↓ | np3 | ||
| ns2 |
Высшая степень окисления в соединениях равна +5; низшая степень окисления равна - 3. Высшие оксиды имеют общую формулу R2O5; водородные соединения - RH3. Из промежуточных степеней окисления +3 является общей для всех элементов.
Изменение свойств элементов по мере увеличения атомного радиуса (сверху вниз по подгруппе) происходит более резко, чем в главных подгруппах VII и VI
групп. Первые два элемента, азот и фосфор, являются типичными неметаллами;
мышьяк проявляет признаки металличности, значительно усиливающиеся у
сурьмы и висмута. Сурьма и висмут принадлежат к металлам.
N2O3 Р2O3 As2O3 Sb2O3 Bi2O3
HNO2 HPO2 HAsO2 Sb(OH)3 Bi(OH)3
(H3PO3) (H3AsO3)
Кислотные Амфотерные, Амфотерные Основные
свойства свойства с свойства с свойства
преобладанием преобладанием
кислотных основных
Аналогичные соединения со степенью окисления элементов +5 имеют более кислотный характер, но их устойчивость снижается с увеличением порядкового номера элемента и для сурьмы и висмута они не являются характерными.
Усиление металличности элементов сверху вниз по подгруппе проявляется и
в свойствах образуемых ими газообразных водородных соединений.
В ряду NH3 - РН3 - AsH3 - SbH3 - BiH3 устойчивость молекул резко
уменьшается, висмутин BiH3 разлагается при комнатной температуре. По
химическим свойствам они отличаются от водородных соединений галогенов и
халькогенов: водные растворы NH3 и РН3 обладают слабоосновными свойствами.
Общей характеристикой водородных соединений элементов подгруппы азота
является их неприятный запах и ядовитые свойства, которые усиливают в ряду:
NH3→ РН3→ AsH3.
Наиболее распространенными в природе элементами являются фосфор (0,09%) и азот (0,03%). Они входят в число органогенных элементов.
2. Азот и его свойства.
Азот - заряд ядра (+7).
Электронная формула: ls22s22p3
Электронно-графическая формула внешнего слоя:
| ↑ | ↑ | ↑ | |
| ↑↓ | 2np3 | ||
| 2ns2 |
Максимальная валентность азота ограничена числом валентных атомных
орбиталей и равна IV. По величине относительной электроотрицательности азот
уступает фтору и кислороду, проявляя в соединениях с ними положительные
степени окисления (от +1 до +5). В соединениях с менее электроотрицательными элементами (металлами, водородом) азот имеет степень окисления (- 3).
Элемент азота образует одно простое вещество N2 (молекулярный или свободный азот); также входит в состав сложных неорганических и органических веществ.
Неорганические соединения азота:
| Степень окисления | -3 | +1 | +2 | +3 | +4 | +5 | |
| Химическое соединение | NH3 | N2 | N2O | NO | N2O3 | NO2 | N2O5 |
| Нитриды: Na3N Ca3N2 Соли аммония: NH4Cl (NH4)SO4 | HNO2 Нитриты: KNO2 NaNO2 | HNO3 Нитраты: KNO3 NaNO3 |
В природе основная часть азота находится в свободном состоянии - N2. Из неорганических соединений азота только натриевая селитра (NaNO3) в виде пластов имеется на побережье Тихого океана в Чили. В составе сложных органических соединений (белков, нуклеиновых кислот) азот присутствует во всех живых организмах.
Молекула азота состоит из двух атомов, связанных между собой тройной ковалентной неполярной связью:
. .
|


 :N· + ·N: :N N:
:N· + ·N: :N N:
. .
Связь очень прочная, разрывается при t°>3000°C.
Взаимодействие между молекулами азота очень слабое, поэтому азот имеет низкие t°пл.= - 210° С и tкип. = - 196°С. N2 - бесцветный газ, не имеет запаха, мало растворим. В воздухе азота - 78,2% по объему. В промышленности азот получают фракционной перегонкой воздуха; в лабораторных условия путем термического разложения азотсодержащих соединений
60°С
NH4NO2 === N2+2H2O
Молекулярный азот - химически малоактивное вещество. Его инертность обусловленна большой прочностью внутримолекулярной связи. При обычной температуре N2 реагирует только с литием; остальные реакции протекают при высоких температурах, но в большинстве случаев являются обратимыми.
Для азота характерными являются реакции, в которых он является окислителем
(N + 3ē → N -3):
N2 + 6 Li = 2Li3N
t0
N2 + 3 Mg = Mg3N2
Нитриды подвергаются необратимому гидролизу.
MgN2 + 4Н2O = 2NH3↑ +Mg(OH)2↓
Реакция с водородом протекает при высокой t°, в присутствии катализатора
t0, кт
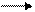 N2+3H2 2NH3
N2+3H2 2NH3
Для смещения равновесия в сторону образования аммиака применяют давление до 1000 атм.
3. Аммиак. Соли аммония.
Аммиак являет одним из важнейших соединений азота. Три ковалентные связи в молекуле аммиака образуются в результате перекрывания электронных облаков трех р-электронов атома азота и s-электронов трех атомов водорода.
Физические свойства: бесцветный газ с характерным резким запахом. Легче воздуха, хорошо растворим в воде (при комнатной температуре в 1 объеме воды растворяется 700 объемов аммиака). Концентрированный раствор имеет массовую долю аммиака 25%; плотность 0,91 г/см3, раствор аммиака в воде называется аммиачной водой или нашатырным спиртом t кип NH3 = 33,5°С; tпл.= 77,8 С.
Физические свойства: при обычных условиях аммиак представляет собой бесцветный газ с характерным резким запахом, легче воздуха, хорошо растворимый в воде (в IV воды растворяется ~ 700 V аммиака). Концентрированный раствор имеет массовую долю аммиака, равную 25%; плотность 0,91 г/см3, раствор аммиака в воде - аммиачная вода или нашатырный спирт. Ткип. = - 33,5°С; Тпл = - 77,8°С.
В лаборатории аммиак можно получить, нагревая хлорид аммония с
гидроксидом кальция.
t0
2NH4CI + Са(ОН)2 = СаС12 + NH3 + Н2O
Водный раствор аммиака имеет щелочную реакцию вследствие образования
гидроксида аммония NH4OH, дисоциирующего на ионы NH+4 и ОН-:
 NH3 + Н2O NH4OH NH+ + ОН-
NH3 + Н2O NH4OH NH+ + ОН-
Таким образом, водный раствор аммиака ведет себя как слабое основание.
Аммиак отличается большой реакццонной активностью, которая обусловлена особенностями строения его молекул: в аммиаке азот имеет саму низкую степень окисления (-3), поэтому может отдавать электроны, и является сильным восстановителем; а также атом азота в молекуле аммиака имеет неподеленную электронную пару, которая может участвовать в образовании донорно-акцепторной связи, например с ионом водорода, вследствие чего аммиак проявляет основные свойства.
Восстановительные свойства аммиака.
В чистом кислороде аммиак сгорает до азота и воды:
4NH3 + 3O2 = 6Н2O+ 2N2
в присутствии катализатора - до оксида азота (II) и воды:
4NH3 + 5O2 = 4NO + 6Н2O
Взаимодействует с галогенами, реакции протекают очень активно, в атмосфере фтора и хлора аммиак воспламеняется:
2NH3 + C12 = N2 + 6HC1
Восстанавливает некоторые металлы из их оксидов:
3Сu + 2NH3 = N2 + 3Cu + 3H2O
В связи с тем, что молекула аммиака способна присоединять к себе протон водорода по донорно-акцепторному механизму, аммиак дает щелочную реакцию на лакмус и другие кислотно-основные индикаторы, а также взаимодействует с кислотами. Это говорит о проявлении основных свойств.
При взаимодействии аммиака с кислотами идет образование солей аммония, содержащих положительный радикал NH+4
2NH3 + H2SO4 = (NH4)2SO4 - сульфат аммония
NH3 + HNO3 = NH4NO3 - нитрат аммония
NH3 + HC1 = NH4Cl - хлорид аммония
NH3 + H3PO4 = (NН4)3РO4 - фосфат аммония
Соли аммония образуются также при взаимодействии кислот с раствором аммиака:
3NH4OH + 3Н3РО4 = (NH4)3PO4 + 3Н2O
Донорно-акцепторный механизм образования связей лежит в основе взаимодействия аммиака с солями некоторых металлов, в результате чего образуется аммиакаты (комплексные соединения):
CuSO4 + 4NH3 = [Cu(NH3)4]SO4 - сульфат тетраамин меди (II)
AgCl + 2NH3 = [Ag(NH3)2]Cl - хлорид диаминсеребра (I)
Важнейшим свойством солей аммония является их взаимодействие со щелочами (по этой реакции обнаруживающей соли аммония)
NH4CI + NaOH = NaCl + NH3↑+ H2O
Образующийся аммиак определяют по запаху или по индикатору.
При нагревании все соли аммония разлагаются, при этом из солей аммония, образованных:
а) нелетучими кислотами, выделяются только NH3:
t0
(NH4)3PO4 = 3NH3↑ +H3PO4
t0
(NH4)2SO4 = 2NH3↑ +H2SO4
б) летучими кислотами, выделяется аммиак и газ соответствующей кислоты,
при охлаждении которых происходит обратная реакция:
t0
 NH4C1 NH3 + HC1
NH4C1 NH3 + HC1
t0

 (NH4)2S 2NH3 + H2S
(NH4)2S 2NH3 + H2S
в) если соль образована кислотой-окислителем, то происходит окисление
аммиака:
t°
NH4NO3 = N2O + 2H2O
t°
NH4NO2 = N2 + 2H2O
t°
(NH4 )2 Cr2O7= N2 + Cr2O3 + 4 H2O
Гидролиз солей аммония. Соли аммония в водных растворах подвергаются гидролизу по катиону:
 NH4+ + H2O NH4OH + H+
NH4+ + H2O NH4OH + H+
Раствор солей аммония имеют слабокислую реакцию, если соль образованa аммиаком и сильной кислотой.
Соль, образованная аммиаком и слабой кислой, подвергается гидролизу по катиону и аниону и среда раствора такой соли близка к нейтральной:
 NH4CN + H2O NH4OH + HCN
NH4CN + H2O NH4OH + HCN
 NH+4+CN- + H2O NH4OH + HCN
NH+4+CN- + H2O NH4OH + HCN
Небольшие отклонения рН от 7 зависят от соотношения констант диссоциации гидроксида аммония и образующейся слабой кислоты.
Применение солей аммония: Нитрат аммония NH4NO3 - как азотсодержащее содержащее удобрение; в сочетании с горючими и взрывчатыми веществами используют в качестве взрывчатой смеси (аммониты):
• Сульфат аммония (NH4)SO4 - как растворимое удобрение;
• Хлорид аммония NH42CI (нашатырь) - в производстве сухих гальванических элементов; при паянии и лужении; в медицине при сердечных отеках;
• Гидрокарбонат аммония NH4HCO3 - как заменитель дрожжей в хлебопечении и кондитерской промышленности;
• Гидрофосфат аммония (NH4)2HPO4 - в хлебопечении.
4. Кислородные соединения азота. Оксиды азота.
Азот образует соединения с кислородом со степенью окисления +1 до +5.
Оксид азота (I) N2O и оксид азота (II) NO - несолеобразующие оксиды.
N2O - газ без цвета, слабый приятный запах, растворим в воде, обладает наркотическим действием («веселящий»); при высокой температуре разлагается:
t0
2N2O = 2N2 + O2
с водой не взаимодействует.
NO - оксид азота (II) газ без цвета, без запаха, малорастворим в воде, ядовит; не взаимодействует с водой, кислотами, основанием. Основные его реакции это окислительно-восстановительные взаимодействия. Как восстановитель легко взаимодействует с кислородом воздуха при обычных условиях
2NO + O2 = 2NO2
NO как окислитель реагирует с галогенами (кроме йода), фосфором, углем, магнием, с серной и хромовой кислотами
t°
2NO + 2H2 = N2 + 2 H2O (взрыв)
NO является промежуточным продуктом в производстве азотной кислоты.
В промышленности NO получают окислением аммиака на платиновом
катализаторе
Pt2+
4NH3 + 5O2 = 4NO + 6Н2O
При очень высокой температуре (электрическая искра или луч лазера) идет
синтез из элементов
 N2 + O2 2NO
N2 + O2 2NO
В лаборатории NO получают при действии разбавленной азотной кислоты на медь
3Сu + 8НNO3(разб.) = 3Cu(NO3)2 + 2NO +Н2O
N2O3 - оксид азота (III), азотистый ангидрид газ красно-бурого цвета, при охлаждении сгущается в синюю жидкость, растворим в воде. Кислотный оксид,
при взаимодействии с водой образует азотистую кислоту
N2O3 + H2O = 2HNO2
Оксид азота (IV) NO2 в промышленности получают из оксида (II), образующегося при окислении аммиака
2NO + O2 = 2NO2
В лаборатории NO2 получают разложением нитрата свинца
2Pb(NO3)2 = 2РbO + O2 + 4NO2
или восстановлением концентрированной азотной кислоты медью
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2Н2O
NO2 - кислотный оксид. При растворении в воде образует азотную и азотистую кислоты. Но азотистая кислота является неустойчивой и распадается
3HNO2 = HNO3 + 2NO + Н2O
Суммарное уравнение:
3NO2 + Н2O = 2HNO3 + NO
Чтобы NO не выделялся, реакцию проводят в присутствии кислорода воздуха
4NO2 + 2Н2O + O2 = 4HNO3
С образованием солей двух кислот происходит реакция оксида азота (IV) со щелочами
2NO2 + 2КOН = KNO3 + KNO2 + H2O
Оксид азота (IV) является сильным окислителем. В атмосфере NO2 горят углерод, фосфор и сера. С ним взаимодействуют и сложные вещества -восстановители.
2NO2 + 2C = N2 + 2CO2
2NO2 + 8HJ = N2 + 4J2+ 4H2O
NO2 - газ буроватого цвета с неприятным запахом, очень ядовит, хорошо растворяется в воде.
Оксид азота (IV) в месте с оксидом азота (II) применяется в производстве азотной кислоты, а также как окислитель в органическом синтезе.
Оксид азота (V), азотный ангидрид - бесцветные кристаллы, расплывающиеся на воздухе. Растворим в воде. Кислотный оксид. Молекулы неустойчивы, легко разлагаются
2N2O5 = 4NO2 + O2
Разложение происходит со взрывом. В широком интервале температур оксид азота (IV) находится в виде дилеров - N2O4
N2O5 при взаимодействии с водой образует азотную кислоту
N2O5 + Н2O = 2HNO3
5. Азотистая кислота HNO2 существует только в виде водных растворов,
устойчивых ниже 0°С. При более высоких температурах кислота постепенно
разлагается
3HNO2 = HNO3 + 2NO↑+H2O
Азотистая кислота принадлежит к слабым кислотам Кдис=4,0 * 10-4

 HNO2 Н+ + NO2 - нитрит-ион
HNO2 Н+ + NO2 - нитрит-ион
Взаимодействует с химически активными металлами, их оксидами и гидроксидами. HNO2 проявляет окислительные и восстановительные свойства
+3 +2
2HNO2 + 2HI = 2NO↑ +J2↓ + 2H2O
Окислитель
+3 +5
5НNO2 + 2KMnO4 + 3H2SO4 = 5НNО3 + 2MnSO4 + K2SO4 + 3H2O
Восстановитель
Соли HNO2 - нитриты, как правило, бесцветные кристаллические вещества, хорошо растворимые в воде. Исключение - хлорид серебра - AgNO2↓. Нитриты
щелочных металлов плавятся без разложения; остальные нитриты разлагаются
t0
Ca(NO2)2 = СаО + NO2 +NO
t0
AgNO2 = Ag + NO2
Нитриты обладают окислительно-восстановительной двойственностью.
6. Азотная кислота - HNO3 - одна из наиболее сильных кислот, одна из
важнейших минеральных кислот. Основным источником получения в
промышленности является аммиак.
Процесс получение HNO3
1. Окисление аммиака:
4NH3 + 5O2 = 4NO + 6Н2O
Условия: атмосферное давление, катализатор платина в виде тонкой сетки (плюс 5 - 10% родия для прочности), температура 700 - 800С
2. Окисление NO кислородом воздуха:
р
2NO + O2 = 2NO2
3. Поглощение NO2 водой:
3NO2 + Н2O = 2HNO3 + NO
Процесс ускоряется при повышении давления и при понижении температуры.
При данном процессе получается 60 - 62% раствор кислоты. Для получения концентрированной кислоты (выше 96%) разбавленную азотную кислоту (50%) упаривают в присутствии серной кислоты.
В лаборатории получают HNO3 действие концентрированной H2SO4 на нитрат натрия или калия при слабом нагревании
NaNO3 + H2SO4 = NaHSO4 + HNO3
Концентрированный раствор азотной кислоты (98%) обычно бесцветен, но на свету часто желтеет вследствие разложения.
4HNO3 = 4NO2↑ + O2 + 2Н2O
С водой HNO3 смешивается в любых соотношениях.
Концентрированный раствор азотной кислоты является сильным
окислителем
Pb + 4HNO3(k) = Pb(NO3)2 + 2NO2 + 2H2O
S + 6HNO3(k) = H2SO4 + 6NO2 + 2H2O
Железо, алюминий, хром в холодной кислоте пассивируют, при нагревании растворяются. Не реагирует концентрированная азотная кислота только с золотой, платиной и некоторыми металлами платиновой группы.
Благородные металлы растворяются в «царской водке» (смесь концентрированной азотной кислоты с концентрированной хлороводородной в соотношении 1:3).
Механизм действия «Царской водки»:
1. Окисления соляной кислоты азотной:
HNO3 + 3HC1 = С12 + 2Н2O + NOC1
2. Разложение нитрозила NOC1
NOCl = NO+Cl
Получившийся атомарный хлор является сильным окислителем, который и
окислит металлы
Au + HNO3 + 3НС1 = AuCl3 + NO↑ + 2H2O
3Pt+ 4HNO3 + 12HC1 = 3PtCl4 + 4NO↑ + 8H2O
Менее выраженным окислителем является разбавленная кислота.
Дата добавления: 2016-11-22; просмотров: 628;
