ТОК на аноде на катоде 1 страница
В лаборатории хлор получают действием различных окислителей на концентрическую соляную кислоту. Окислителями является оксид марганца (IV) МnO2, перманганат калия КМnО4, бертолетовая соль КСlO3.
4НС1 + МnO2 = С12↑ + МnС12 + 2Н2O
16НС1 + 2КМnO4 = 5С12↑ + 2МnС12 + 2КС1 + 8Н2O
6НС1 + КСlO3 = 3С12↑+ КС1 + 3Н2O
в) Химические свойства хлора.
Хлор характеризуется высокой химической активностью. Очень сильный окислитель.
Взаимодействие с простыми веществами: с металлами хлор реагирует с образованием галогенидов металлов в их высшей степени окисления. Реакции протекают с выделением большого количества тепла:
Cl2 + 2Na = NaCl
t°
3С12 + 2Fe = 2FeCl3
С водородом хлор взаимодействует на солнечном свету при нагревании:
hb
С12 + Н2 = 2НС1
С менее электроотрицательными неметаллами хлор также реагирует активно:
5С12 + 2Р = 2РС15
t
С12 + S = SC12
С элементами, имеющими высокую ЭО - кислородом и азотом-хлор непосредственно не взаимодействует. Однако с самим электроотрицательным элементом - фтором - хлор проявляет восстановительные свойства:
С12 + 3F2 = 2C1F3 (фторид хлора III)
Взаимодействие со сложными веществами. При растворении в воде хлор образует две кислоты: соляную НС1 и хлорноватистую НСlO:
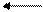
 С12 + Н2O НС1 + НСlO
С12 + Н2O НС1 + НСlO
Реакция обратимая.
Данная реакция относится к типу реакций самоокисления (диспропорционирования),
т.к. одни атомы хлора являются окислителями (С1° + 1ē →Сl), другие -
восстановителями (С1° - 1ē →С1+).
Раствор хлора в воде называется «хлорной водой», которая обладает окисляющим и отбеливающим действием, т.к. хлорноватистая кислота на свету разлагается с образованием атомарного кислорода:
hb
НС1O = НС1+[O]
Аналогичным образом протекает взаимодействие хлора с водными растворами щелочей, при этом образуются соли соответствующих кислот:
С12 + 2КОН = КС1 + КС1O (гипохлорид калия) + н2O
При нагревании образуется более окисленное соединение хлора - хлорат калия
КСlO3:
t
3С12 + 6КОН = 5КС1 + КС1O3 + 3Н2O
Окислительная активность галогенов последовательно уменьшается от фтора к йоду. Это проявляется в способности более активных галогенов окислять галоген-ионы менее активных галогенов. Например, хлор взаимодействует с растворами бромидов и йодидов, вытесняя из них свободные бром и йод:
С12 + 2KBr = 2KC1 +Вr2 (красный)
С12 + 2KJ = 2КС1+J2 (фиолетовый)
С фторидами металлов хлор не реагирует, т.к. его окислительная способность ниже окислительной способности фтора:
Cl2 + KF≠
Хлор взаимодействует также с некоторыми другими веществами -восстановителями, например:
H2S + C12 = S ↓+ 2HC1
Na2SO3 + C12 + Н2O = Na2SO4 + 2HC1
2NH3 + 3C12 = N2 + 6HC1
4. Кислородные соединения хлора.
Кислородосодержащие соединения хлора являются неустойчивыми соединителями, легко разлагаются со взрывом и обладают сильным окисляющим действием. Применяются эти соединения в качестве отбеливающих, дезинфицирующих, легковоспламеняющихся и взрывчатых веществ.
Соединения со степенью окисления хлора +1. Оксид хлора (I) С12O - газ желто-бурого цвета, кислородный оксид. При растворении в воде образует хлорноватистую кислоту:
С12O + Н2O = 2НСlO
При взаимодействии оксид хлора (I) с водными растворами щелочей образуются гипохлориты:
С12O + Са(ОН)2 = Са(СlO)2 + Н2O
При нагревании оксид хлора (I) разлагается:
t°
2С12O = 2С12 + O2
Хлорноватистая кислота существует только в водных растворах, при нагревании которых происходит разложение по типу реакции диспропорционирования:
3НСlO = НСlO3 + НС1
Хлорноватая
Кислота
На свету хлорноватистая кислота разлагается с выделением атомарного кислорода, который является сильнейшим окислителем:
hb
НС1O = НС1 + [O]
Гипохлориты несколько более устойчивы, чем НС10. Они образуются при пропускании хлора в хлоридный раствор щелочи:
С12 + 2КОН = КСlO + КС1+Н2O
2С12 + 2Са(ОН)2 = Са(С1O)2 + СаС12 + 2Н2O
Смесь солей Са(С1O)2 и СаС12(СаОС12) носит название белильной или хлорной извести. Обладает сильным отбеливающим и дезинфицирующим действием, т.к. на воздухе из нее выделяется хлорноватистая кислота, разлагающаяся с образованием атомарного кислорода.
Соединения со степенью окисления хлора +3. Оксид хлора (III) С12O3 не получен. Соответствующая ему хлористая кислота НСlO2 существует только в водных растворах. Ее соли - хлорибты используются для отбеливания тканей.
Соединения со степенью окисления хлора +5. Оксид хлора (V) С12O5 - также не получен. Ему соответствует хлорноватая кислота НСlO3, которая не имеет практического значения. При пропускании хлора в горячий раствор едкого калия образуется хлорат калия КСlO3 (бертолева соль).
t°
3С12 + 6КОН = КСlOз + 5КС1 + 3Н2O
Бертолева соль разлагается, характер продуктов разложения зависит от условий протекания реакции:
t0
2КС1O3 = 2КС1 + 3O2↑
МnO2
Эта реакция используется для лабораторного получения кислорода.
При медленном нагревании в отсутствие катализатора бертолева соль сначала плавится, а затем разлагается:
t>400C°
4КС1O3 == 3КСlO4 + КС1
(реакция диспропорционирования)
Смесь бертолетовой соли с серой, фосфором, углеродом образует взрывчатые смеси. Хлорат калия сильный окислитель.
Соединение со степенью окисления +7. Оксид хлора (VII) С12O7 - бесцветная, маслообразная жидкость. При ударе и нагревании разлагается. Хлорная кислота НСlO4 - существует в свободном состоянии и представляет собой сильно дымящуюся на воздухе жидкость. При нагревании сначала окрашивается в коричнево-красный цвет, а затем взрывается. Водный раствор НСlO4 является сильной кислотой, сильный окислитель.
Соли хлорной кислоты - перхлораты - образуются при взаимодействии НСlO4 с мателлами, их оксидами, гидроксидами и карбонатами. Являются неустойчивыми соединениями и разлагаются при нагревании в результате внутримолекулярного окисления-восстановления.
NaC1O4 = NaCl + 2O2
2NaC1O4 = 2NaC1O3 + O2
Вопросы для самоконтроля:
1. Назовите элементы - галогены и укажите их положение их положение в периодической системе Д.И. Менделеева.
2. Какие валентности и степени окисления характерны для атомов галогенов в различных соединениях?
3. Как изменяются радиусы атомов, сродство к электрону и электроотрицательности галогенов в подгруппе?
4. Какой из галогенов, является самым активным и какой - наименее активным окислителем?
5. Какие свойства - окислительные или восстановительные - проявляют галогенид - ионы?
6. Как получают хлор в промышленности и в лаборатории?
7. Какие свойства проявляет хлор в реакциях взаимодействия с простыми веществами?
8. К какому типу окислительно-восстановительных реакций относится взаимодействие хлора с водой?
9. Напишите формулы известных оксидов хлора и назовите их.
Напишите формулы кислот соответствующих оксидам хлора и назовите их. Приведите примеры солей, образованных кислородосодержащими кислотами хлора
Лекция № 18.
Тема: Галогениды. Биологическая роль галогенов и галогенидов.
План
1. Галогениды.
2. Особенности хлорид-иона
3. Комплексные соединения галогенов
4. Биологическая роль галогенов:
а) фтор
б) хлор
в) бром
г) йод
1. Галогениды
Элементы VII группы главной подгруппы имеют общее название галогены, т.е. солеобразователи. До завершения оболочки благородного газа им не хватает одного электрона, поэтому они способны образовывать отрицательно заряженные ионы с металлами и с менее электроотрицательными неметаллами. С водородом они образуют галогеноводородные кислоты, которые за исключением фтороводородной кислоты, являются сильными. Восстановительные свойства галогеноводородных кислот повышается в ряду СГ, Br-,J-.Ocoбые свойства проявляет фтороводородная кислота: действует на все металлы, кроме золота и платины, разрушает стекло и силикаты:
SiO2 + 4HF = SiF4 + 2H2O
По этой причине фтороводородная кислота не может храниться в стеклянной посуде.
Большинство галогенидов металлов являются ионами соединениями, легко растворимы в воде (кроме галогенидов Ag+, Hg+, Cu+), в растворенном и расплавленном состоянии хорошо проводят электрический ток.
Галогениды неметаллов являются ковалентными соединениями: нерастворимые в воде, но легко гидролизуемые под ее действием с образованием соответствующей кислородной кислоты и галогеноводорода:
РС15 + 4Н2O = Н3РO4 + 5HC1
Кроме степени окисления (-1), галогены за исключением фтора образуют соединения с более высокими степенями окисления: хлор и йод могут иметь максимальную степень окисления (+7); бром - (+6).
2. Особенности хлорид - иона.
Индифферентность анионов Сl- в кислой среде существенно с точки зрения физиологии и медицины.
Используя индифферентность хлорид - иона, его вводят в состав многих лечебных препаратов. Водные растворы натрия хлорида - изотонический (массовая доля 0,9%) и гипертонические (массовая доля 3 - 5 - 10%) широко применяют в медицинской практике. Использование гипертонических растворов основано на законах осмоса.
Хлорид - ион присутствует в организме в макроколичествах. В форме соляной кислоты является необходимым компонентом желудочного сока. Соляная кислота играет важную роль в процессе пищеварения.
Желудочный сок (рН от 1 до 3) содержит катион Н+ и анионы С1-, Н2РО-4) HSO-4. Однако концентрация хлорид ионов значительно превышает концентрацию других анионов. Соляная кислота содержится в желудочном соке, и ее массовая доля составляет около 0,3%.
Для выработки соляной кислоты в желудке необходим NaCl - поваренная соль. Выделение соляной кислоты из клеток слизистой оболочки желудка объясняется уравнением:
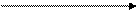 Н2СO3(кровь) + С1- НСО-3 (кровь) + HC1 (желудок)
Н2СO3(кровь) + С1- НСО-3 (кровь) + HC1 (желудок)
Белки пищи






Соляная кислота желудочного сока необходима для перехода фермента пепсина в активную форму. Пепсин обеспечивает переваривание белков путем гидролитического расщепления пептидных связей (отсюда и название фермента):
Пепсин
 R-CO-NH-R1+H2O RCOOH + R1NH2
R-CO-NH-R1+H2O RCOOH + R1NH2
HC1
3. Комплексные соединения галогенов.
Галогены входят в состав комплексных соединений как в качестве лигандов, так и комплексообразователей. Более склонны элементы VII А группы к комплексообразованию в качестве лигандов с ионами металлов.
Образование комплексных галогенидов имеет место и в живых организмах. Так, токсическое действие избытка фторид - ионов на организм связано с образованием фторидных комплексов с катионами металлов, входящих в активные центры ферментов. В результате блокирования свободной орбитали металла подавляется активность ферментов.
Важными комплексными соединениями галогенов, применяемых в медицине, являются противоопухолевые препараты (химиотерапия). Активными считаются цис-диаминдихлороплатина (II) [Pt(NH3)2Cl2] и цис-диаминтетрахлороплатина (IV) [Pt(NH3)2Cl4].
 Известны комплексы, где комплексообразователем является галогенид-ион, а лигандами - молекулы галогенов. Такие комплексы состава [Г • (Г2)х]- называются полигалогенидами. Так, увеличение растворимости молекулярного йода в воде в присутствии калия йодида связано с образованием комплексного иона: J + J2 J(J2)]-. Диссоциация комплекса (реакция обратимая) обеспечивает присутствие в растворе полииодида элементарного йода, обладающего бактерицидными свойствами. Поэтому в медицинской практике используют раствор йода с добавлением йодида калия.
Известны комплексы, где комплексообразователем является галогенид-ион, а лигандами - молекулы галогенов. Такие комплексы состава [Г • (Г2)х]- называются полигалогенидами. Так, увеличение растворимости молекулярного йода в воде в присутствии калия йодида связано с образованием комплексного иона: J + J2 J(J2)]-. Диссоциация комплекса (реакция обратимая) обеспечивает присутствие в растворе полииодида элементарного йода, обладающего бактерицидными свойствами. Поэтому в медицинской практике используют раствор йода с добавлением йодида калия.
4. Биологическая роль галогенов.
По содержанию в организме человека хлор (0,15%) относится к макроэлементам, в то время как остальные элементы этой группы являются микроэлементами (содержание их ~10-5%). Галогены в виде различных соединений входят в состав тканей человека и животных. Хлор и йод относятся к незаменимым элементам, а остальные являются постоянными составными частями тканей. В организме все галогены имеют системы окисления (-1), хлор и бром находятся в виде гидратированных ионов С1- и Вr-; фтор и йод - в связанном виде в составе некоторых биоорганических соединений. В следствие уменьшения электроотрицательности в ряду Е- - С- - Br- - J- связь углерода с йодом наименее полярная. Поэтому йод находится в живых организмах в виде элементоорганических соединений со связью (С - J).
а) Фтор. Масса фтора в организме человека составляет около 7 мг (~10-5%). Соединения фтора концентрируются в костной ткани, ногтях, зубах. В состав зубов входит около 0,01% фтора, причем большая часть приходится на эмаль, что связано с присутствием в ней труднорастворимого фторапатита Са5(РO4)3F. Недостаток фтора в организме приводит к кариесу зубов. Минеральную основу зубных тканей - дентина составляют гидроксилапатит Са5(РO4)3ОН; хлорапатит Са5(РO4)3С1; фторапатит Ca5(PO4)3F. Фторид - ион легко замещает гидроксид -ион в гидроксилапатите, образуя защитный эмалевый слой более твердого фторапатита:
 Са5(РO4)3ОН + F- Ca5(PO4)3F + OH-
Са5(РO4)3ОН + F- Ca5(PO4)3F + OH-
Также фторид - ион способствует осаждению кальция фосфата, тем самым, ускоряя процесс реминерализации (образование кристаллов):
10Са2+ + 6РO43- + 2F- = 3Ca3(PO4)2 CaF2
Очень часто разрушению подвергается не внешняя поверхность зуба, покрытая слоем эмали, а внутренние участки дентина, обнаженные при повреждении эмали. Имеются предпрложения, что пока эмаль повреждена незначительно, введение натрия фторида способствует образованию фторапатита, облегчая реминерализацию начавшегося повреждения.
Обогащение питьевой воды фтором, т.е. фторирование воды с целью доведения содержания в ней фтора до нормы (1мг/л), приводит к снижению заболеваемости. Фторирование воды осуществляется добавлением к ней натрия фторида.
Натрий фторид NaF используется в медицинской практике в качестве местно действующего наружного средства. Его применение основано на образовании фторапатита:
 NaF + Ca5(PO4)3OH NaOH + Ca5(PO4)3F - зубная ткань
NaF + Ca5(PO4)3OH NaOH + Ca5(PO4)3F - зубная ткань
паста
При этом происходит одновременно и подщелачивание среды ротовой полости, что способствует нейтрализации кислот, вырабатываемых бактериями.
Избыток фтора вреден. При содержании фтора в питьевой воде выше допустимой нормы (1,2 мг/л) зубная эмаль становится хрупкой, легко разрушается, и появляются симптомы хронического отравления фтором - повышение хрупкости костей, костные деформации и общее истощение организма. Возникающее заболевание называется флюорозом (фторозом). б) Хлор. В организме человека содержится примерно 100 г хлора (массовая доля 0,15%). Хлорид - ион ативируют некоторые ферменты, создают благоприятную среду для действия протолитических ферментов желудочного сока, обеспечивают ионные потоки через клеточные мембраны, участвуют в поддержке осмотического равновесия.
Хлорид - ион имеет оптимальный радиус для проникновения через мембрану клеток, что объясняет его совместное участие с ионами натрия и калия в создании определенного осмотического давления в регуляции водносолевого обмена. Суточная потребность натрия хлорида 5 – 10 г. Поваренная соль помимо участия для выработки соляной кислоты, необходимой в процессе пищеварения, уничтожает различные болезнетворные бактерии (холеры, тифа). Если в желудок с большим количеством воды попадают бактерии, то вследствие разбавления НС1 не оказывает антибактериального действия и бактерии выживают. При недостаточном количестве соляной кислоты в желудке повышается рН и нарушается нормальное пищеварение. При пониженной кислотности желудочного сока в. медицинской практике используют разбавленный раствор соляной кислоты.
При воспалении желудка (гастрите), язвенной болезни секреция желудочного сока увеличивается, повышается его кислотность, что требует специального лечения и обязательного уменьшения количества поваренной соли, потребляемой с пищей.
Жизненно необходимые хлорид - ионы не обладают токсикологическим действием, в то время как элементарный хлор - высокотоксичный газ, применяющийся в первую мировую войну в качестве отравляющего вещества. Предельно допустимая концентрация газообразного хлора в воздухе 0,001 мг/л. в) Бром. Масса брома в организме человека составляет около 7 мг (~10-5%). Он локализуется в желудках внутренней секреции, в частности, в гипофизе. Биологическая роль соединений брома в нормальной жизнедеятельности организма изучена недостаточно. По некоторым данным предполагается, что соединения брома угнетают функцию щитовидной железы и усиливают активность коры надпочечников. При введении в организм бромид - ионов наиболее чувствительной оказывается центральная нервная система. Бромид -ионы равномерно накапливаются в различных отделах мозга и действуют успокаивающе при повышенной возбудимость, т.е. бромид - ионы способствуют восстановлению нарушенного равновесия между процессами возбуждения и торможения.
По ионному радиусу, электроотрицательности и другим физико-химическим характеристикам бром занимает промежуточное положение между хлором и йодом, следовательно, бромид - ионы могут замещать в организме ионы хлора и йода. Примером такого взаимозамещения является замещение йода бромом при избытке брома в организме в гормонах щитовидной железы, что приводит к гипертиреодизму.
В организме существует определенная динамическая связь между содержанием в ней бромид- и хлор - ионов и при повышении концентрации бромид - ионов в крови нарушается равновесие, что способствует быстрому выделению почками хлорид - ионов и наоборот (принцип Ле Шантелье).
Бромид - ионы легко всасываются в желудочно-кишечном тракте. Токсичность бромид - ионов невысока, но вследствие медленного выведения из организма (в течение 30-60 суток) они могут кумулировать, что приводит к развитию хронического отравления (бромизм). В этом случае необходимо прекратить прием бромидных препаратов. Кроме того, вводят большое количество натрия хлорида (до 25 г в сутки) с целью увеличения скорости выделения бромид - ионов (принцип Ле Шателье), назначают обильное питье.
г) Йод. В организме человека содержится около 25 мг (4-10-5%) йода. Йод относится к числу незаменимых биологических элементов, и его соединения играют важную роль в процессах обмена веществ. Имеются данные, что йод влияет на синтез некоторых белков, жиров, гормонов.
Из общего количества йода в организме больше находится в щитовидной железе в связанном состоянии (в виде гормонов) и только 1% его находится в виде иодид - иона. Щитовидная железа способна концентрировать йод в 25 раз больше по сравнению с содержанием его в плазме. Щитовидная железа секретирует гормоны тироксин и трииодтиронин.
Понижается активность щитовидной железы (гипотиреоз) может быть связана с уменьшением ее способности накапливать иодид - ионы, а также с недостатком в пище йода (эндемический зоб). При этом заболевании назначают препараты йода: калий иодид KY или натрий иодид NaY в дозах, соответствующих суточной потребности человека в йоде (0,001 г калия йодида). В районах, где имеется дефицит йода, для профилактики эндемического зоба добавляют к поваренной соли NaY или KY (йод - 2,5 г на 100 кг).
При повышенной активности щитовидной железы (гипертиреоз) вследствие избыточного синтеза тиреоидных гормонов наблюдается увеличение скорости метаболических процессов.
Йодид калия применяют при гипотиреозе (иодид - ион используется для синтеза гормонов), а также и при гипертиреозе (иодид - ион тормозит йодирование тирозина йодом).
При неэффективности указанных препаратов для лечения гипертиреоза применяют препарат радиоактивного йода 131Y, излучение которого разрушает фолликулы щитовидной железы и тем самым уменьшает избыточный синтез гормонов.
Иодид натрия и иодид калия используют такие как отхаркивающие средства при воспалительных заболеваниях дыхательных путей.
Таким образом, все р-элементы VII А - группы физиологически активны, а хлор и йод незаменимы для жизнедеятельности организма. Однако и фтор можно считать необходимым для функционирования живых организмов.
В организме галогены взаимозамещаемы, при этом наблюдаются случаи как синергизма, так и антагонизмы.
Вопросы для самоподготовки:
1. В виде, каких ионов галогены присутствуют в организме?
2. Какова биологическая роль фтора, хлора и йода в организме?
3. Напишите химическое уравнение, выражающее механизм выделения соляной кислоты из клеток слизистой оболочки желудка.
4. Какие неорганические соединения хлора, фтора, брома и йода применяют в медицине?
5. Каков механизм токсического действия избытка фторид - ионов на организм?
6. Какие комплексные соединения хлора применяют для лечения онкологических заболеваний?
7. Почему в медицинской практике используют раствор йода с добавлением калия иодида?
8. Какие галогены относятся к незаменимым элементам?
9. Напишите уравнение реакции, объясняющее применения натрия фторида и зубной пасты, содержащей натрия фторид, как средств, повышающих сопротивляемость зубов к кариесу.
10. В каких органах концентрируются преимущественно фтор, бром, йод в
организме?
11. На чем основано введение в организм больших количеств натрия хлорида при отравлении бромом?
12. Почему калий иодид применяют как при гипертиреозе, так и при
гипотиреозе?
Лекция № 19.
Тема: Халькогены. Общая характеристика элементов VI группы периодической системы Д.И. Менделеева. Соединения кислорода.
План
1. Общая характеристика халькогенов.
2. Кислород и его соединения:
а) нахождения в природе, физические свойства 02 и Оз, получение 02 и 03;
б) химические свойства свободного кислорода;
в) соединения кислорода с водородом.
3. Сера, Аллотропные видоизменения, химические свойства.
1. Общая характеристика халькогенов.
В VI А группу периодической системы элементов Д.И. Менделеева входят кислород, сера, селен, теллур, полоний. Первые четыре из них имеют неметаллический характер. Общее название элементов этой группы халькогены (рудообразующие), что указывает на их нахождение в природе. Электронная формула валентной оболочки атомов элементов VI А группы - ns2np4. атомы этих элементов имеют по 6 валентных электронов на s - и р- орбиталях внешнего энергетического уровня. Из них две р- орбитали заполнены наполовину.
Атом кислорода отличается от атомов других халькогенов отсутствием низколежащего d-подуровня, поэтому кислород, как правило, способен образовывать только две связи с атомами других элементов. Однако в некоторых случаях наличие неподеленных пар электронов на внешнем энергетическом уровне позволяет атому кислорода образовывать дополнительные связи по донорно-акцепторному механизму.
У атомов остальных халькогенов при поступлении энергии извне число неспаренных электронов может увеличиваться в результате перехода s- и р-электронов на d-подуровень. Поэтому атомы серы и других халькогенов способны образовывать не только 2, но также и 4, и 6 связей с атомами других элементов. Например, у атома серы в возбужденном состоянии электроны внешнего энергетического уровня приобретают электронную конфигурацию 3s23p33d1 и 3s13p33d2:
| ↑↓ | ↑ | ↑ | 3d0 | |||||
| ↑↓ | 3p4 | |||||||
| 3s2 |
| ↑ | ||||||||
| ↑ | ↑ | ↑ | 3d1 | |||||
| ↑↓ | 3p4 | |||||||
| 3s2 |
Дата добавления: 2016-11-22; просмотров: 2043;
