Методика составления уравнений реакций окисления – восстановления
I. Составление уравнений простейших реакций.
При составлении уравнений ОВР необходимо определить восстановитель и окислитель, а также число отдаваемых и принимаемых ими электронов. Для этого необходимо знать окислительно-восстановительную характеристику реагентов: величины потенциалов ионизации сродства к электрону и элетроотрицательности. Число электронов, отдаваемых восстановителем и принимаемых окислителем, определяется степенью окисления атомов и ионов до и после реакции.
Коэффициенты в уравнениях для восстановителя и окислителя должны подбираться с таким расчетом, чтобы общее число электронов, отданных восстановителем, равнялось общему числу электронов, принятых окислителем.
В качестве примера рассмотрим реакцию окисления алюминия кислородом.
Al + O2 =
Определяем, что является восстановителем и окислителем. Алюминий – элемент главной подгруппы III группы периодической системы, активный металл. Следовательно, алюминий будет в реакции проявлять только восстановительный свойства, его атом отдает 3 электрона.
Кислород находится в главной подгруппе VI группы, очень активный неметалл, является сильнейшим окислителем. Молекула О2 принимает 4 электрона.
Составляем вспомогательные уравнения, выражающие процессы отдачи и присоединения электронов и находим коэффициенты при восстановителе и окислителе.
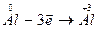
| восстановитель, процесс окисления | |
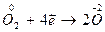
| окислитель, процесс восстановления |
Числа 3 и 4 в электронных уравнениях справа от вертикальной черты и являются коэффициентами в уравнении реакции.
Уравнение в окончательном виде:
4Al + 3O2 = 2Al2O3
Правильность написания уравнения проверяем путем подсчета атомов каждого элемента в левой и правой частях уравнения.
II. Составление уравнений сложных реакций.
На скорость и направление ОВР влияет ряд факторов: природа реагирующих веществ, характер среды, концентрация реагентов, температура, катализатор. Реакционная способность молекул зависит от их химического строения и условий взаимодействия.
Влияние среды на химический процесс велико и в некоторых случаях она изменяет даже направление процесса.
Для создания в растворе кислой среды обычно пользуются серной кислотой. Соляная и азотные кислоты применяются реже, так как первая способна окисляться, а вторая сама является сильным окислителем и потому может вызывать побочные процессы.
Для создания щелочной среды применяется гидродсид натрия или гидроксид калия.
При составлении уравнений реакций с участием среды необходимо руководствоваться следующими правилами:
1. Если образующиеся вещества содержат больше кислорода, чем исходные соединения, то недостающее количество кислорода пополняется в кислых и нейтральных растворах за счет воды, а в щелочных растворах – за счет ионов ОН.
2. Если образующиеся вещества содержат меньше кислорода, чем исходные, то освобождающийся кислород в кислой среде реагирует с ионами водорода Н+ с образованием очень слабо диссоциированных молекул воды, а в нейтральной и щелочной среде – с образованием гидроксид – ионов.
3. В кислой или нейтральной среде ионы металлов (одно-, двух- и трехзарядные) взаимодействуют с кислотными остатками и образуют соли.
4. Ионы металлов, дающие нерастворимые в воде гидроксиды, в щелочной среде образуют соответствующие гидроксиды.
5. Ионы металлов (двух-, трех- и четырехзарядные), способные давать амфотерные гидроксиды, образуют в щелочной среде гидроксосоли.
Рассмотрим составление уравнения реакции сульфита натрия с перманганатом калия в зависимости от характера среды.
В кислой среде
Na2SO3 + KMnO4 + H2SO4 →
Определим восстановитель, окислитель, их степени окисления, а также необходимые коэффициенты. Руководствуясь окислительно-восстановительными свойствами реагентов, устанавливаем, что в молекуле сульфита натрия, диссоциирующей в растворе 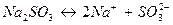 , ион SO
, ион SO 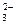 является восстановителем – в нем сера в степени окисления (+4) отдает 2 электрона и повышает степень окисления до (+6) с образованием иона SO
является восстановителем – в нем сера в степени окисления (+4) отдает 2 электрона и повышает степень окисления до (+6) с образованием иона SO 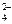 ; в молекуле
; в молекуле 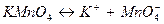 анион
анион 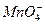 является окислителем – в нем марганец в степени окисления (+7) принимает 5 электронов и понижает степень окисления до (+2), превращаясь в катион
является окислителем – в нем марганец в степени окисления (+7) принимает 5 электронов и понижает степень окисления до (+2), превращаясь в катион 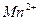 .
.
Коэффициенты для восстановителя и окислителя находим, пользуясь схемой электронного баланса.
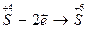
| восстановитель, процесс окисления | |
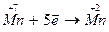
| окислитель, процесс восстановления |
Напишем в правой части уравнения формулы образующихся соединений.
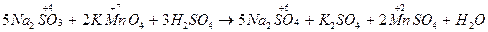
По числу кислотных остатков в правой части уравнения находим коэффициент для кислоты. В результате реакции получается 8 кислотных остатков 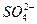 , из них 5 – за счет окислительно-восстановительного процесса (превращение
, из них 5 – за счет окислительно-восстановительного процесса (превращение 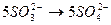 ), а 3 – за счет молекул серной кислоты (
), а 3 – за счет молекул серной кислоты ( 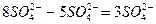 ). По числу ионов водорода (6H+) в левой части уравнения находим коэффициент для воды.
). По числу ионов водорода (6H+) в левой части уравнения находим коэффициент для воды.
Уравнение примет окончательный вид:

Признаком правильности подбора коэффициентов является одинаковое количество атомов каждого элемента в обеих частях уравнения.
Вопросы для самоконтроля
Выполните задания:
I. Определить степень окисления элементов в следующих соединениях: серная кислота, сернистая кислота, сероводородная кислота, азотистая кислота, нитрат калия, нитрат алюминия, сульфат железа (III), сульфат железа (II), сульфат магния, фосфат бария, карбонат натрия, силикат кальция.
II. Сколько электронов отдано атомами при следующих превращениях:
1. 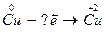 2.
2.  3.
3. 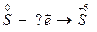 4.
4. 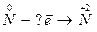 5.
5. 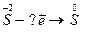
| 6. 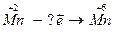 7.
7. 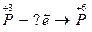 8.
8. 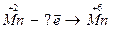 Какой процесс – окисление или восстановление при этом происходит?
Какой процесс – окисление или восстановление при этом происходит?
|
III. Сколько электронов принято атомами при следующих превращениях:
1. 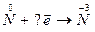 2.
2. 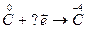 3.
3. 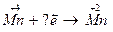 4.
4. 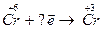 5.
5. 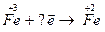
| 6. 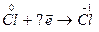 7.
7. 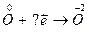 8.
8. 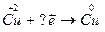 9.
9. 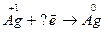 Какой процесс – окисление или восстановление при этом происходит?
Какой процесс – окисление или восстановление при этом происходит?
|
IV. Как меняется число электронов в атомах при следующих изменениях степеней окисления:
1. 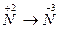 2.
2. 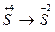 3.
3. 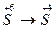 4.
4. 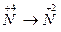
| 5. 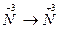 6.
6. 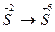 7.
7.  В каких происходит окисление, а в каких – восстановление?
В каких происходит окисление, а в каких – восстановление?
|
V. Составьте уравнение следующих окислительно-восстановительных реакций, если известны конечные степени окисления элементов:
1. 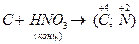
2. 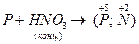
3. 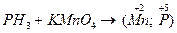
Завершите составление уравнений окислительно-восстановительных реакций и укажите роль нитрит-иона 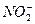 , гидроксиламина и гидразина.
, гидроксиламина и гидразина.
1. 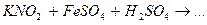
2. 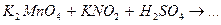
3. 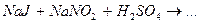
4. 
5. 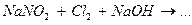
6. 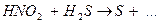
7. 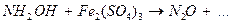
8. 
9. 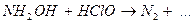
10. 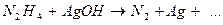
11. 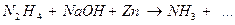
Литература
Основные источники:
1. Общая химия/ Л.М. Пустовалова, И.Е. Никанорова. - Ростов - на - Дону: Феникс,2005. - 478с. - (Среднее профессиональное образование).
2. Химия:Учебник для студ. сре.мед. учеб. заведений/ А.В.Бабков, Т.И.Барабанова, В.А. Попков. - М.: Издательский центр «Академия», 2003. - 272с.
3. Ерохин Юрий Михайлович. Сборник задач и упражнений по химии(с дидактическим материалом): Учебное пособие для студентов спо/Ю.М.Ерохин, В.И.Фролов.-М:Изд.центр «Академия», 2005.- 304с.
4. Литвинова Т.Н.Сборникзадач по общей химии: Учебное пособие для студентов мед. Вузов – 3-е изд., перераб./Т.Н. Литвинова, -М.,: ООО «Издательство ОНИКС» : ООО Издательство «Мир и образование», 2007. – 224 с. – (Высшее образование).
5. Пустовалова Лидия Михайловна. Неорганическая химия: Серия «Средне профессиональное образование»/ Л.М. Пустовалова, И.Е. Никанорова.- Ростов н/Д: Феникс, 2005.-352с.
6. Габриелян Олег Саргисович. Химия для преподавателя:учеб.-метод.пособие / О.С. Габриелян, Г.Г. Лысова.- Москва: Академия,2006.-206,(1)с: рис., табл..-(Среднее профессиональное образование. Общеобразовательные дисциплины).
7. Ерохин Ю.М. Химия учеб. для сред. проф. учеб. заведений -5-е. изд., стер. – М: Издательский центр «Академия», 2005. – 384 с.
8. Угай Я.А. Общая и неорганическая химия. Учеб. для вузов 2-е изд., исп. – М : Высшее шк. , 2000 – 527 с. ил.
Лекция №15
Тема: Важнейшие окислители и восстановители. ОВР с участием дихромата, перманганата калия и разбавленных кислот.
План
1. Восстановители и окислители.
2. Восстановители имеющее большое значение в технике и лабораторной практике.
3. Группа окислителей.
4. Окислители, имеющие большое значение в технике и лабораторной практике.
1. Восстановители и окислители
Группа восстановителей: восстановителями могут быть нейтральные атомы металлов - восстановительные свойства металлов зависят от агрегатного состояния, среды, величины радиуса атома и количества валентных электронов. Сильными восстановителями являются атомы с малым потенциалом ионизации. К ним относятся атомы электронов двух первых главных подгрупп периодической системы элементов - щелочные и щелочноземельные металлы, а также алюминий, железо и другие. Франций является самым сильным восстановителем из всех элементов периодической системы. В химических реакциях восстановители отдают электроны согласно схеме: Me – пē → Меп+.
Восстановительные свойства проявляют и неметаллы (углерод, водород); отрицательно заряженные ионы неметаллов (к данной группе относятся анионы в бескислородных кислотах и их солях: H2S-S2- ,H2Se-Se2- HJ-J-, HBr-Br- и другие. Сильные восстановительные свойства проявляют водород, находящийся в степени окисления (-1), т.е. в гидридах металлов - СаН2); положительно заряженные ионы металлов в низшей степени окисления (это ионы металлов, которые при взаимодействии с сильными окислителями могут
еще повышать свою степень окисления: Sn+2 , Fe+2 , Cr+2 , Мn+2 ); сложные ионы и молекулы, содержащие атомы в состоянии промежуточной степени окисления (сложные ионы SO32-, NO-2, AsO33-, CrO-2, [Fe (CN)6]4- проявляют восстановительные свойства, так как у них атомы серы, азота, мышьяка, хрома и железа находятся в состоянии промежуточной степени окисления: S+4, N+3 As+3,
Cr+3, Fe+2 ; аналогичными свойствами обладают и некоторые молекулы: SO2, СО, NO).
2. Восстановители, имеющие большое значение в технике и лабораторной
практике
Железо (Fe), цинк (Zn), алюминий (Аl) и олово (Sn) применяются в качестве восстановителей в производстве органических соединений (восстановление нитросоединений).
Углерод (С) - применяется для восстановления металлов из оксидов.
С + ZnO = Zn + СО
Окись углерода (СО) - играет важную роль в металлургии при восстановлении металлов из их оксидов.
СО + 3Fe2O3 = 2Fe3O4 + СO2
СО + Fe3O4 = 3FeO + CO2
FeO +CO = Fe + СO2
Водород так же проявляет восстановительные свойства - водородотермия.
СО + Н2 = С + H2J
СиО + Н2 = Си + Н2O
СО +2Н2 = СН3ОН
Сернистая кислота используется в качестве восстановителя для получения в свободном виде неорганических веществ, восстановления их ионов и других органических соединений.
Сернистая кислота в водном растворе диссоциирует по схеме:
H2SO3 ↔ H+ + HSO3-↔ H+ + SO2-3;
Ион SO23-, проявляя восстановительные свойства, отдает 2ē и превращается в ион SO42- как в кислой, так и в нейтральной средах.
Сульфит (Na2SO3) и гидросульфит натрия (NaHSO3) применяется для восстановления в фотографии (Na2SO3) и в текстильной промышленности (NaHSO3) для уничтожения следов хлора в отбеленных тканях.
NaHSO3 + Cl2 + H2O = NaHSO4 + 2HCl
Сульфид натрия (Na2S) используется для восстановления ароматических нитро- и азосоединений. Сульфид-ион окисляется до элементарной серы S° или до сульфат-иона SO2-4 в зависимости от силы окислителя, его концентрации и
+4
температуры. При реакциях обжига ион S2- окисляется до SO2.
Тиосульфат натрия (Na2S2O3) применяется в качестве восстановителя в красильном деле с целью освобождения отбеливаемого материала от избытка хлорноватистой кислоты.
Na2S2O3 + 4НC1O + Н2O = 2H2SO4 + 2NaCl + 2 НСl
Металлический натрий (Na) как восстановитель может быть использован для получения в свободном виде элементов подгруппы титана.
4Na + ЭС14 = Э + 4NaCl
Водород (Н) - атомарный водород значительно более активен, чем молекулярный и при обычных условиях взаимодействует с серой, мышьяком; восстанавливает многие металлы из их оксидов и солей.
Водородотермия широко применяется в промышленности для получения чистого вольфрама, молибдена, германия, кобальта.
2Н2 + GeO2 = Ge + 2H2O
H2 + СоО = Со+ Н2O
Электрический ток - под его действием протекает электролиз,
сопровождающийся восстановлением катиона на катоде и окислением аниона на
аноде. При электролизе раствора хлористого никеля протекают процессы:
на катоде на аноде 0
Ni2+ + 2e = Ni0 2СГ -2e = 2С10 →С1 2
3. Группа окислителей
Окислителями могут быть: нейтральные атомы и молекулы (сильными окислителями являются неметаллы - фтор, кислород, хлор); положительно заряженные ионы металлов (сильные окислители - положительно заряженные ионы с высокой степенью окисления; Fe3+, Cu2+, Sn4+); сложные ионы и молекулы, содержащие атомы металла в состоянии высшей степени окисления
+7 +6 +6 +4
(КМпO4, К2 Сr2O7, K2 CrO4, Pb (СН3СOOl4); сложные ионы и молекулы, содержащие атомы неметалла в состоянии высшей положительной степени окисления (к числу этих окислителей относятся кислородные кислоты, их
ангидриды и соли: +5 +6 +6 +1 +5 +5
H NOз, H2SO4, SO3 HOC1 НС1O3 КC1O3.
4. Окислители, имеющие большое значение в технике и лабораторной практике.
Кислород (О2) - применяется для интенсификации производственных процессов в металлургической и химической промышленности; используется в смеси с ацетиленом для получения высоких температур (3500°С) при сварке и резке металлов; широко применяется в медицине, вдыхание 40-60% смеси кислорода с воздухом ускоряет процессы окисления в организме, уменьшая нагрузку на сердце и легкие. Кислород является сильным окислителем, особенно при нагревании. Атомарный кислород значительно активнее молекулярного. Восстановительные свойства кислород проявляет лишь по отношению к фтору.
2NaOH+2F2 = OF2 + 2NaF + H2O
Озон (O3) - более сильный окислитель, чем кислород. Он обесцвечивает многие красящие вещества, окисляет металлы (за исключением золота, платины), аммиак в азотистую и азотную кислоты, сульфиды в сульфаты. Озон убивает бактерии, поэтому применяется для обеззараживания воды и для дезинфекции воздуха. Озон легко разлагается с выделением атомарного кислорода.
O3 = O2 + O
Озон легко окисляет серебро.
Ag + J3 = AgO + O2
Перманганат калия (КМnO4) - очень сильный окислитель, применяется для окисления многих органических соединений. Окисляет сульфиты в сульфаты,
нитриты в нитраты, йодистый калий до свободного йода, соляную кислоту до
хлора, перекись водорода до кислорода. Характер восстановления КМnO4
зависит от среды, в которой протекает реакция:
в кислой среде (рН < 7)
КМпO4 ↔ К+ + МпО-;
МпО4- → Мп2+
фиолетово- слабо-розовая
малиновая или бесцветная
окраска окраска
в нейтральной или слабощелочной среде (рН > 7)
МпО-4 → МпO2↓
фиолетово- бурый
малиновая
окраска
в сильнощелочной среде (рН » 7)
МпО4- → МпО42-;
фиолетово- зеленая
малиновая окраска
окраска
Хромовая и двухромовая кислоты - используются соли этих кислот:
хромат калия К2СrO4 и бихромат калия К2Сг2O7
СrO42-; ; Сr2O72;
желтая оранжевая
окраска окраска
Все соли хромовых кислот, а также ангидрид хромовой кислоты (СгO3) в кислой среде являются сильными окислителями:
Сr2+6О72 → Сr+3
Сr+6O3- → Сr+3
Азотная кислота (HNO3) - сильнейший окислитель. Азот в составе аниона NO-3 может в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) принимать от 1 до 8 электронов:
+5 +4 +2 +1 0 -3
NO3→-NO2→NO →N2O→N2 →NН3,
При восстановлении азотной кислоты практически не выделяется газообразный водород.
Pb + 4HNO3 = Pb(NO3)2 + 2NO2 .+ 2H2O
коиц.
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
разб.
3Ca+ 10HNO3 = 4Ca(NO3)2 + N2O + 5H2O
конц.
5Co+ 12 HNO3 = 5Co(NO3)2 + N2 + 6H2O
очень
разбавл.
4Mg+ 10 HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
очень
разбавл.
Большинство неметаллов восстанавливают азотную кислоту до оксида азота (II).
Азотная кислота широко применяется в производстве химико-фармацевтических препаратов (стрептоцид), органических красителей, целлулоида, кино- и фотопленки. В клинических методах исследования мочи используется 1% раствор азотной кислоты.
Азотная кислота (HNO3) - является окислителем, но при взаимодействии с более сильными окислителями сама проявляет восстановительные свойства, окисляясь до азотной кислоты. Азотистая кислота и ее соли (KNO2, NaNO2) применяются в производстве органических красителей.
Серная кислота (H2SO4 концентрированная) сильный окислитель, особенно при высокой температуре: окисляет
С → СO2 Си → Си+2
S → SO2 Ag→ Ag+
HJ → J2 Hg→ Hg+2
При взаимодействии мало активных металлов и металлов средней активности с концентрированной H2SO4 продуктом восстановления является SO2.
Сu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Серная кислота концентрацией выше 93% не действует на железо (пассивирует).
В случае сильных восстановителей (щелочных и щелочно-земельных металлов) продуктом восстановления будет H2S.
4Mg + 5H2SO4 = H2S + 4MgSO4 + 4H2O
Серная кислота применяется при синтезе лекарственных веществ, в металлургии, производстве красителей.
Перекись водорода (Н2O2) применяется для отбеливания тканей, слоновой кости, соломы, мехов. Сильно разбавленная перекись применяется в медицине для дезинфекции ран. Перекись водорода может проявлять как окислительные:
2KJ + Н2O2 + H2SO4 =J2 + K2SO4 + 2Н2O
так и восстановительные свойства:
5 Н2O2 + 2КМnO4 + 3H2SO4 – 5O2 + MnSO4 + K2SO4 + 8H2O
а также способна к реакциям дисмутации (диспропорционирования)
Н2O2 + Н2O2 = O2 + 2Н2O
Вопросы для самоподготовки:
1. Расставить коэффициенты в ОВР с участием концентрированной серной кислоты.
1. C + H2SO4 → SO2+CO2+H2O
2. Р + H2SO4 → Н3РО4 + SO2 + Н2O
3. S + H2SO4 →SO2 +H2O
4. Си + H2SO4 → CuSO4 + SO2 + H2O
5. Zn + H2SO4 → ZnSO4 +S + H2O
6. Zn + H2SO4 →ZnSO4 + H2S + H2O
7. Al + H2SO4 →Al2SO4 + SO2 + H2O
8. Ag + H2SO4 →Ag2(SO4)3 + SO2 + H2O
9. HBг + H2SO4 →Br2 + SO2 + H2O
10. KJ + H2SO4 → J2 + H2S + K2SO4 + H2O
11. KBr + H2SO4 →Br2 +SO2 + K2SO4+ H2O
12. H2S + H2SO4→S + H2O
13. Co(ОH)3 + H2SO4→CoSO4 + H2O + O2
2. Расставить коэффициенты в ОВР с участием азотной кислоты и
нитратов.
1. Си + HNO3 (конц.)→Cu(NO3)2 + NO2↑ + H2O
2. Cu + HNO3 (разб.) →Cu(NO3)2 + NO↑ + H2O
3. Mg + HNO3 (конц.,60%-ая)→ Mg(NO3)2 + NO2↑ + H2O
4. Mg + HNO3 (30%-ая)→Mg(NO)3)2 + NO↑ + H2O
5.Mg + HNO3 (20%-ая)→Mg(NO3)2 + N2O↑ + H2O
6. Mg + HNO3 (10%-ая)→Mg(NO3)2 + N2↑ + H2O
7. HNO3 + FeSO4 + H2SO4 →Fe2(SO4)3 + NO ↑ + H2O
8. HNO3 + FeS →Fe{NO3)2 + S + NO2↑+ H2O
9. HNO3 (конц.)+ ZnS →ZnSO4 + NO2↑ + H2O
10. HNO3 {конц) + HC1→C12↑ + NO↑ + H2O
11. HNO3 + HC1→C12 + NOC1 + H2O
3. Расставить коэффициенты в ОВР с участием хрома и его соединений.
1. К2Сr2О7 + KNO2 + H2SO4 → Cr2(SO4)3 + KNO3, + K2SO4 + Н,O
2. K2Cr2O7 + SO2 + H2SO4 →Cr2(SO4)3 + K2SO4 + Н2O
3. K2Сг2O77 + H2S + H2SO4 →Сг2(SO4)3 + s + K2SO4 + H2O
4. K2Сг2O7 + НC1 →СгС13 + КС1 + С12 + Н2O
5. K2Cr2O7 +HJ + H2S04 -> Cr2(S04)3 + J2 + K2SO4 + H2O
 O
O
6. 
 K2Cr2O7 + С2Н5ОН + H2SO4 →CH3 + Cr2(SO4)3 + K2SO4 + H2O
K2Cr2O7 + С2Н5ОН + H2SO4 →CH3 + Cr2(SO4)3 + K2SO4 + H2O
H
 С
С  C
C
7. 


 K2Cr2O7 +СН3 + H2SO4 → CH3 + Cr2(SO4)3 + K2SO4 + H2O
K2Cr2O7 +СН3 + H2SO4 → CH3 + Cr2(SO4)3 + K2SO4 + H2O
H
H
C

8.  К2Сr2O7 + C2H5OH + H2SO4 →CH3 + Cr2(SO4)3 + K2SO4 + H2O
К2Сr2O7 + C2H5OH + H2SO4 →CH3 + Cr2(SO4)3 + K2SO4 + H2O
H
4. Расставить коэффициенты в ОВР с участием марганца и его соединений.
1. KMnO4 + Na2SO3+ H2SO4 →Na2SO4 + K2SO4 + MnSO4 + H2O
2. KMnO4 + Na2SO3 + H2O →MnO2 + Na2SO4 + KOH
3. KMnO4 + Na2SO3 + NaOH →K2MnO4 + Na2SO4 + Na2MnO4+ H2O
4. KMnO4 + K2SO3 + H2SO4 →MnSO4 + K2SO4 + H2O
5. KMnO4 + K2SO3 + H2O→MnO2 + K2SO4 + KOH

 O
O
6.  KMnO4 + CH3OH + H2SO4 →H – C + МnSO4 + K2SO4 + H2O
KMnO4 + CH3OH + H2SO4 →H – C + МnSO4 + K2SO4 + H2O
H

 O O
O O
7. 


 KMNO4 + Н- C + H2SO4→-Н-С + MnSO4 + K2SO4 + H2O
KMNO4 + Н- C + H2SO4→-Н-С + MnSO4 + K2SO4 + H2O
H OH

 O
O
8.  KМnO4 + СH3ОH + H2SO4 → H – C + МnSO4 + K2SO4 + Н2O
KМnO4 + СH3ОH + H2SO4 → H – C + МnSO4 + K2SO4 + Н2O
OH
O
9. 

 KМnO4 + С2Н5ОН + H2SO4 →СН3 – С + MnSO4 + К2SO4 + H2O
KМnO4 + С2Н5ОН + H2SO4 →СН3 – С + MnSO4 + К2SO4 + H2O
H
 O
O


 O
O
10. 
 KMnO4 +CH3 - C + H2SO4 → СH3 – С + MnSO4 + K2SO4 + H2O
KMnO4 +CH3 - C + H2SO4 → СH3 – С + MnSO4 + K2SO4 + H2O
H OH
Лекция №16
Тема: Методы расстановки коэффициентов в ОВР.
План
1. Методика составления уравнений реакции окисления - восстановления. 2.Составление уравнений сложных реакций.
3. Особые случаи составления уравнений окислительно-восстановительных реакций.
1. Методика составления уравнений реакций окисления - восстановления
I. Составление уравнений простейших реакций.
При составлении уравнений ОВР необходимо определить восстановитель и окислитель, а также число отдаваемых и принимаемых ими электронов. Для этого необходимо знать окислительно-восстановительную характеристику реагентов: величины потенциалов ионизации сродства к электрону и элетроотрицательности. Число электронов, отдаваемых восстановителем и принимаемых окислителем, определяется степенью окисления атомов и ионов до и после реакции.
Коэффициенты в уравнениях для восстановителя и окислителя должны подбираться с таким расчетом, чтобы общее число электронов, отданных восстановителем, равнялось общему числу электронов, принятых окислителем.
В качестве примера рассмотрим реакцию окисления алюминия кислородом.
А1 + 02 =
Определяем, что является восстановителем и окислителем. Алюминий -элемент главной подгруппы IIIгруппы периодической системы, активный металл. Следовательно, алюминий будет в реакции проявлять только восстановительный свойства, его атом отдает 3 электрона.
Кислород находится в главной подгруппе VI группы, очень активный неметалл, является сильнейшим окислителем. Молекула О2 принимает 4 электрона.
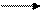  АI-3ё АI3+ восстановитель, процесс окисления 4
O20 +4ё 2 О-2окислитель, процесс восстановления 3
Числа 3 и 4 в электронных уравнениях справа от вертикальной черты и являются коэффициентами в уравнении реакции. Уравнение в окончательном виде:
4А1 + 302 = 2А1203
Правильность написания уравнения проверяем путем подсчета атомов каждого элемента в левой и правой частях уравнения.
2. Составление уравнений сложных реакций. АI-3ё АI3+ восстановитель, процесс окисления 4
O20 +4ё 2 О-2окислитель, процесс восстановления 3
Числа 3 и 4 в электронных уравнениях справа от вертикальной черты и являются коэффициентами в уравнении реакции. Уравнение в окончательном виде:
4А1 + 302 = 2А1203
Правильность написания уравнения проверяем путем подсчета атомов каждого элемента в левой и правой частях уравнения.
2. Составление уравнений сложных реакций.
|
Составляем вспомогательные уравнения, выражающие процессы отдачи и присоединения электронов и находим коэффициенты при восстановителе и окислителе
На скорость и направление ОВР влияет ряд факторов: природа реагирующих веществ, характер среды, концентрация реагентов, температура, катализатор. Реакционная способность молекул зависит от их химического строения и условий взаимодействия.
Влияние среды на химический процесс велико и в некоторых случаях она изменяет даже направление процесса.
Для создания в растворе кислой среды обычно пользуются серной кислотой. Соляная и азотные кислоты применяются реже, так как первая способна окисляться, а вторая сама является сильным окислителем и потому может вызывать побочные процессы.
Для создания щелочной среды применяется гидродсид натрия или гидроксид калия.
При составлении уравнений реакций с участием среды необходимо руководствоваться следующими правилами:
1. Если образующиеся вещества содержат больше кислорода, чем исходные соединения, то недостающее количество кислорода пополняется в кислых и нейтральных растворах за счет воды, а в щелочных растворах - за счет ионов ОН.
2. Если образующиеся вещества содержат меньше кислорода, чем исходные, то освобождающийся кислород в кислой среде реагирует с ионами водорода Н+ с образованием очень слабо диссоциированных молекул воды, а в нейтральной и щелочной среде - с образованием гидроксид - ионов.
3. В кислой или нейтральной среде ионы металлов (одно-, двух- и трехзарядные) взаимодействуют с кислотными остатками и образуют соли.
4. Ионы металлов, дающие нерастворимые в воде гидроксиды, в щелочной среде образуют соответствующие гидроксиды.
5. Ионы металлов (двух-, трех- и четырехзарядные), способные давать амфотерные гидроксиды, образуют в щелочной среде гидроксосоли.
Рассмотрим составление уравнения реакции сульфита натрия с перманганатом калия в зависимости от характера среды.
В кислой среде
 Na2SOs + КМп04 + H2S04
Na2SOs + КМп04 + H2S04
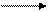
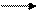 Определим восстановитель, окислитель, их степени окисления, а также необходимые коэффициенты.Руководствуясьокислительно восстановительными - свойствами реагентов, устанавливаем, что в молекуле сульфита натрия, диссоциирующей в растворе Na2S03 2Na+ + SO2-3 , ион SO23; является восстановителем - в нем сера в степени окисления (+4) отдает 2 электрона и повышает степень окисления до (+6) с образованием иона SO2-4; в молекуле КМп04 К+ Мп04- анион Мп04-является окислителем- в нем марганец в степени окисления (+ 7) принимает 5 электронов и понижает степень окисления до (+2), превращаясь в катион Mn2+
Определим восстановитель, окислитель, их степени окисления, а также необходимые коэффициенты.Руководствуясьокислительно восстановительными - свойствами реагентов, устанавливаем, что в молекуле сульфита натрия, диссоциирующей в растворе Na2S03 2Na+ + SO2-3 , ион SO23; является восстановителем - в нем сера в степени окисления (+4) отдает 2 электрона и повышает степень окисления до (+6) с образованием иона SO2-4; в молекуле КМп04 К+ Мп04- анион Мп04-является окислителем- в нем марганец в степени окисления (+ 7) принимает 5 электронов и понижает степень окисления до (+2), превращаясь в катион Mn2+
Коэфициенты для восстановителя и окислителя находим, пользуясь схемой электронного баланса.
По числу кислотных остатков в правой части уравнения находим коэффициент для кислоты. В результате реакции получается 8 кислотных остатков SO2', из них 5 - за счет окислительно-восстановительного процесса (превращение 5S032- 5S042-), а 3 - за счет молекул серной кислоты (8S042 - 5S024 = 3S02-4). По числу ионов водорода (6Н+) в левой части уравнения находим коэффициент для воды.
Уравнение примет окончательный вид:
5Na2S03 + 2КМп04 + 3H2S04 =5Na2S04 + K2S04 + 2MnS04 + 3Н20
Признаком правильности подбора коэффициентов является одинаковое количество атомов каждого элемента в обеих частях уравнения.
При составлении реакций можно использовать и электронно-ионный метод, в которых сильные электролиты записывают в виде ионов, а слабые электролиты, газы и осадки в виде молекул.
В ионную схему реакции включают те частицы, которые проявляют восстановительные или окислительные свойства, а также частицы, характеризующие среду: кислую - ион Я4\ щелочную - ион ОН, нейтральную -молекула Н20.
Пример взаимодействия КМп04 с Nа2SO3в кислой среде.
Электронно-ионные уравнения составляются отдельно для процесса восстановления и процесса окисления.
МпО-4 + 8Н+ + 5ё = Мп2+ + 4Н2О
SO3-2+ Н20 -2ё = SO42-+ 2Н+
Общее число электронов, отдаваемых восстановителем, должно быть равно числу электронов, присоединяемых окислителем - находим коэффициенты для окислителя и восстановителя:
 МпО4-; + 8Н+ + 5ё = Мп2+ + 4Н20 2
МпО4-; + 8Н+ + 5ё = Мп2+ + 4Н20 2
| SO32- + Н20 -2ё = SO42-+ 2Н+ |
Суммируем электронно-ионные уравнения (предварительно умноженные на коэффициенты).
2МпО-4 + 16Н+ + 5S032-,' + 5Н20 = 2Мп2+ + 8H20 + 5SО42- + 10Н+
Сократив подобные члены, находим ионное уравнение:
2Мп0-4 + 5SO23+ 6Н+ = 2Мп2+ + 5S042- + 3Н20
Это уравнение в молекулярной форме имеет вид:
2КМпО4 + 5Na2S03 + 3Н2S04 = 2МnS04 + 5Na2S04 + 3H20 + K2S04
При составлении уравнений окислительно-восстановительных реакций электронно-ионным методом надо помнить следующее:
в ионной форме записываются только формулы веществ, распадающихся в растворе на ионы;
во всех случаях сначала уравнивается число кислородных атомов;
в кислой среде кислород отдает молекулы воды, а связывается он ионами водорода.
Реакции, протекающие в щелочной среде. Например:
CrC13+NaC1O+ NaOH → Na2CrO4 + NaC1 + H2O.
Последовательность действий сначала такая же, как и при реакции в кислой среде. Записываем схему в ионной форме:
Cr3+ +3C1--+Na+ +CIO- + Na++OH-→ 2Na+CrO42- +Na+ + C1-+ H2О.
Выписываем формулы ионов, претерпевающих изменения и определяющих среду:
Cr3++ 8OH-→CrO42-+4H2O
Рассматриваем разницу в числе кислородных атомов. В щелочной среде кислород поставляют ионы OH-. Каждые 2 иона OH- нужно вдвое больше, чем требуется атомов кислорода:
Cr3++ 8OH→CrO42-+ 4H2O
Подсчитываем заряды:
Cr3++ 8OH-→CrO42-+ 4H2O

 -5 -2
-5 -2
Происходит отдача трех электронов ионом Cr3+. Он окисляется и является восстановителем:
Cr3+ + 8OH-→CrO42-+4H2O + 3e-
Превращение ClO- в Cl- требует связывания атомов кислорода. Это осуществляется молекулами воды. Каждая молекула воды, принимая один атом кислорода, превращается в 2 иона OH-:
ClO- + H2O → Cl- + 2OH-
Подчитываем заряды :
ClO- + H2O→ Cl- + 2OH-

 -1 -3
-1 -3
Ион ClO- принимает 2 электрона , ClO- восстанавливается окислителем:
ClO- + H2O + 2e-→ Cl- + 2OH-
Далее все так же, как в кислой среде:

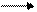 Cr3+ + 8OH- CrO42- + H2O +3e- 2
Cr3+ + 8OH- CrO42- + H2O +3e- 2
ClO- + H2O + 2e-→ Cl- + 2OH- 3

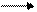 2Cr3+ + 16OH- + 3 ClO- + 3H2O 2CrO42- +8H2O + 3 HCl- + 6OH-
2Cr3+ + 16OH- + 3 ClO- + 3H2O 2CrO42- +8H2O + 3 HCl- + 6OH-
Приводим подобные члены :
2Cr3+ + 10OH- + 3ClO = 2 CrO42- + 5H2O + 3Cl-
Расставим коэффиценты в молекулярном уравнении:
2CrCl3 + 3NaClO +10NaOH = 2Na2CrO4 + 9 NaCl + 5H2O
При составлении уравнений в щелочной среде правила те же, но кислород предоставляют ионы OH-, а связывается он молекулой воды.
Реакции, протекающие в нейтральной среде :
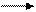 KMnO4 + K2SO4 + H2O K2SO4 + MnO2
KMnO4 + K2SO4 + H2O K2SO4 + MnO2
Рассмотрим, как диссоциируют вещества :
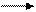 K+ + MnO4- + 2K+ +SO32- + H2O 2K+ + SO42- + MnO2
K+ + MnO4- + 2K+ +SO32- + H2O 2K+ + SO42- + MnO2
Выписываем ионы, претерпевающие изменения, и формулу воды, образующей среду:
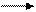 MnO4- + SO32- + H2O SO42- + MnO2
MnO4- + SO32- + H2O SO42- + MnO2
Начинаем с уравнивания числа кислородных атомов.
Поскольку среда нейтральная, добавлять кислород и связывать его можно только молекулами воды. Отдавая кислород, они превращаются в ионы OH+ , а принимая – в ионы OH-. Каждая молекула воды может принять один атом кислорода, превращаясь при этом в 2 иона OH-:
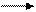 MnO4- + 2H2O MnO2 + 4OH-
MnO4- + 2H2O MnO2 + 4OH-
Подсчитываем заряды:
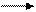 MnO4- + 2H2O MnO2 + 4OH-
MnO4- + 2H2O MnO2 + 4OH-

 -1 -4
-1 -4
Ион MnO4- принимает 3 электрона. Он- окислитель:
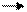 MnO4- + 2H2O +3e- MnO2 + 4OH-
MnO4- + 2H2O +3e- MnO2 + 4OH-
Каждая молекула воды можеит отдать 1 атом кислорода, превращаясь при этом в 2 иона H+
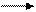 SO32- + H2O SO42- + 2H+
SO32- + H2O SO42- + 2H+
Подсчитываем заряды
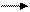 SO32- + H2O SO42- + 2H+
SO32- + H2O SO42- + 2H+

 -2 0
-2 0
Происходит отдача двух электронов :
 SO32- + H2O SO42- + 2H+ + 2 е-
SO32- + H2O SO42- + 2H+ + 2 е-
Ион SO32- - восстановитель.
Соединим оба электро-ионных уравнения:

 MnO4- + 2H2O +3e- MnO2 + 4OH- 2
MnO4- + 2H2O +3e- MnO2 + 4OH- 2
 SO32- + H2O SO42- + 2H+ + 2 е- 3
SO32- + H2O SO42- + 2H+ + 2 е- 3

 MnO4- + 2H2O + 3SO32- + 3H2O 2MnO2- + 8OH- +6H+ + 3SO42-
MnO4- + 2H2O + 3SO32- + 3H2O 2MnO2- + 8OH- +6H+ + 3SO42-
В правой части равенства 8 ионов OH- и 6 ионов H+. Они образуют между собой 6 молекул воды и 2 иона OH-. Получаем:
 2MnO4- + 7H2O + 3SO32- 2MnO2 _ 6 H2O +2OH- + 3 SO42-
2MnO4- + 7H2O + 3SO32- 2MnO2 _ 6 H2O +2OH- + 3 SO42-
Приводим подобные члены:
 2MnO4- + H2O + 3SO32- 2MnO2 +2OH- + 3 SO42-
2MnO4- + H2O + 3SO32- 2MnO2 +2OH- + 3 SO42-
Проявление в правой части свободных ионов OH- свидетельствует об образовании щелочи. Ставим коэффициенты в молекулярное уравнение:
2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3 K2SO4 + 2KOH
3. Особые случаи составления уравнений окислительно-восстановительных реакций
1. Если числа электронов, отдаваемых восстановителем и принимаемых окислителем, являются четными, то при нахождении коэффициентов эти числа делят на наибольший общий делитель!
+5
3Н2 Se+403 +НСIO3 = 3H2 Se+604 + НСI-1


 +4Se - 2ё +6Se 6 3
+4Se - 2ё +6Se 6 3
-
 CI+5 + 6ё С1 2 1
CI+5 + 6ё С1 2 1
2. Если числа электронов, отдаваемых восстановителем и принимаемых окислителем, нечетные, а в результате реакции должно получиться четное число атомов, то коэффициенты удваиваются.
10K Br-1 + 2КМп+704 + 8H2S04 = 5Br2° + 6K2S04 + 2Mn+2S04 + 8H20

 -10
-10
 Вr-1е Вr 5 10
Вr-1е Вr 5 10
+7 +2
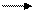 Мn + 5е Мn 1 2
Мn + 5е Мn 1 2
3. Иногда окислитель или восстановитель расходуется дополнительно - на
солеобразование.
0
3Си + 2HN+503 + 6HN3= 3Cu+2(N03)2 + 2N+2 О + 4H20
В этой реакции на 3 атома восстановителя, Сu, требуется 2 молекулы окислителя, HN03; кроме того, на образование нитрата меди и воды расходуется еще 6 молекул HN03.
4. Нередко в молекуле окисляются одновременно атомы с положительной
и отрицательной степенью окисления.
3As+32S-23 +28HN+503 +4H20 = 6H3As+504 +9H2S+6O4+ 28N+2O
2∙2 + 8∙3 3
5. Восстановителем и окислителем могут быть различные атомы одного и
того же элемента, входящие в состав разных веществ.
5KJ-1 + KJ+503+3H2 S04 = 3J02 + 3K2S04 + 3H20
6. Комплексные соединения могут проявлять восстановительные или
окислительные свойства.
а) изменение зарядности иона - комплексообразователя
5K4[Fe+2(CN)6] + KMn+704 + 4H2S04= 5K3[Fe+3(CN)6] +Mn+2S04 4- 3K2SO4 + 4Н20
б) выделение комплексообразователя в виде нейтрального атома
Zn0 + 2[Ag+1(NH3 )2]OH = 2Ag 0+ [Zn+2(NH3 )4](OH)2
Вопросы для самоподготовки:
1. Расставить коэффициенты, используя электронно-ионный метод, в
следующих уравнениях окислительно-восстановительных реакций, протекающих в кислой среде:
1.  КМп04 + NaN02 + H2S04 K2S04 + NaNO, + MgS04 + H20
КМп04 + NaN02 + H2S04 K2S04 + NaNO, + MgS04 + H20
2.  KMn04 + KBr + H2S04 K2S04 + Br2 + MgS04 + H20
KMn04 + KBr + H2S04 K2S04 + Br2 + MgS04 + H20
3.  NaCIO + KJ + H2S04 NaCl + K2S04 + J2 + H20
NaCIO + KJ + H2S04 NaCl + K2S04 + J2 + H20
4.  NaCI + K2Cr2O7 + H2S04 Na2S04 + Cl2 + K2S04 + Cr2(SO4)3,
NaCI + K2Cr2O7 + H2S04 Na2S04 + Cl2 + K2S04 + Cr2(SO4)3,
5.  K2Cr2O7+ KJ + H2S04 Cr 2(S04)3 + J2 + K2S04 + H20
K2Cr2O7+ KJ + H2S04 Cr 2(S04)3 + J2 + K2S04 + H20
в щелочной среде:
1. 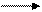 MnCl2 + KBr О + КОН Ми<92 + KBr + KCl + Н20
MnCl2 + KBr О + КОН Ми<92 + KBr + KCl + Н20
2. 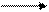 KMn04 + Na2S03 + КОН Na2S04 + К2МnO4 + Н20
KMn04 + Na2S03 + КОН Na2S04 + К2МnO4 + Н20
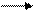 3. k Cr O2 + Cl2 + KOH K2 Cr O4+KCl+ Н20
3. k Cr O2 + Cl2 + KOH K2 Cr O4+KCl+ Н20
4. 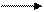 Cr2(S04)3 + Br2 + NaOH Na2Cr04 + NaBr + Na2S04 + Н20
Cr2(S04)3 + Br2 + NaOH Na2Cr04 + NaBr + Na2S04 + Н20
5.  FeS04 + NaCIO + NaOH Fe(OH)3 + NaCl + Na2S04 + H20
FeS04 + NaCIO + NaOH Fe(OH)3 + NaCl + Na2S04 + H20
6.  Al + KN02 + KOH NH3 + KAI02 + H20
Al + KN02 + KOH NH3 + KAI02 + H20
7.  7. CrCI3 + H20+KOH K2CrO4+ KCl+ Н20
7. CrCI3 + H20+KOH K2CrO4+ KCl+ Н20
в нейтральной среде:
1.  KMn04 + KN02 + H20 МnO2 +K3
KMn04 + KN02 + H20 МnO2 +K3
2.  S02 + NaJO3 + Н20 NaJ + H2S04
S02 + NaJO3 + Н20 NaJ + H2S04
3.  KBr + KМn04 + H20 Bг2 + Мn02 + KOH
KBr + KМn04 + H20 Bг2 + Мn02 + KOH
 4. Na2S04 + Bг2 + H20 Na2S04 + HBr
4. Na2S04 + Bг2 + H20 Na2S04 + HBr
3. Особые случаи составления уравнений окислительно-восстановительных реакций
1. Если числа электронов, отдаваемых восстановителем и принимаемых окислителем, являются четными, то при нахождении коэффициентов эти числа делят на наибольший общий делитель!
3Н2 S+4e03 Н+5СIO3 = 3H2 Se+604 + НСI-1


 +4Se - 2ё +6Se 6 3
+4Se - 2ё +6Se 6 3
 CI+5 + 6ё С1 2 1
CI+5 + 6ё С1 2 1
2. Если числа электронов, отд
Дата добавления: 2016-11-22; просмотров: 1628;
