ТОК на аноде на катоде 3 страница
Этот метод лечения с высокой эффективностью применяют в кардиологии, реанимации, неврологии, хирургии. Для общего улучшения обменных процессов при лечении сердечно-сосудистых заболеваний в желудок вводят кислородную пену в виде кислородного коктейля.
Сера - макроэлемент, суточная потребность взрослого человека 4 - 5г. Сера входит в состав белков, аминокислот (цистина, цистеина, метионина и др.), гормонов (инсулина), витаминов (B1). Много серы содержится в каротине волос, костях, нервной ткани. Аминокислоты, содержащие серу, характеризуются наличием водородсульфидных (тиоловых) - SH-групп (цистеин) или наличием дисульфидных связей (-S-S-) - цистин. При окислении тиоловых групп образуются дисульфидные связи и, наоборот, при восстановлении связей (-S-S) образуется SH - группы, то есть переходы обратимы. Этот обратимый переход защищает организм от радиационных поражений. Под влиянием ионизирующего облучения в организме образуются свободные радикалы. Водородсульфидные группы вступают в реакции со свободными радикалами, предотвращая воздействие активных радикалов на нуклеиновые кислоты и другие биомолекулы.
В живых организмах сера, входящая в состав аминокислот, окисляет. Конечными продуктами этого процесса являются преимущественно сульфаты, а также тиосульфаты, элементная сера и политионовые кислоты:

 SO42-
SO42-
 S2O32-
S2O32-

-SH окислительные ферменты
 S4O62-
S4O62-
 S8
S8
Образующиеся в организме эндогенная серная кислота участвует в обезвреживании ядовитых соединений - фенола, крезола, индола, вырабатываемых в кишечнике из аминокислот микробами. Серная кислота связывает многие чужеродные для организма соединения (ксенобиотики) - лекарственные препараты и их метаболиты. Со всеми этими соединениями серная кислота образует относительно безвредные вещества - конъюнктивиты, в виде которых они и выводятся из организма. Например, с мочой человека выделяется конъюгат -калиевая соль сернокислого эфира фенола:


 с6н5о - s - о - к
с6н5о - s - о - к
 о
о
о
В медицинской практике широко применяют как саму серу, так и многие ее соединения: сера осажденная, натрий тиосульфат Na2S2O3 • 5Н2O, сульфаты Na2SO4 • 10Н2О, CuSO4 • 5Н2O, ZnSO4 • 7Н2O.
Вопросы для самоподготовки:
1. Напишите электронную конфигурацию и дайте сравнительную характеристику элементов VI А группы.
2. Какую степень окисления проявляет кислород в следующих веществах: O2, F2O, HNO3, Н2O? Какой тип связи в этих веществах?
3. С какими из следующих веществ будет взаимодействовать кислород: NO, СН4, К, Fe, С12, N2. Au, SO2? Для возможных реакции составьте их уравнения.
4. Какой объем кислорода потребуется и какой объем азота получится при сгорании 2 л аммиака?
5. С какими из перечисленных веществ вода вступает во взаимодействие: СО, SO2, CaO, SiO2, C12, Fe, Fe2? Для возможных реакций составьте их равнения.
6. К 200 мл 27%-го раствора КОН (плотность 1,25г/см3) прибавили 1 л воды. Определите массовую долю (%) полученного раствора.
7. Напишите электронную формулу атома серы и распределите электроны по ячейкам.
8. Для следующей реакции диспропорционирования напишите полуреакции для окислителя и восстановителя и расставьте коэффициенты: S + КОН → K2S + K2SO3 + Н2O.
9. Приведите примеры реакций, в которых сера проявляет: а) окислительные свойства; б) восстановительные свойства.
10. Приведите примеры биологически важных серосодержащих соединений.
Лекция №20
Тема: Важнейшие соединения серы.
План
1. Водородные соединения серы.
2. Кислородные соединения серы:
а) оксиды серы;
б) кислоты; сернистая, серная, тиосерная.
3. Соли кислородных кислот серы и их применение.
1. Водородные соединения серы.
Сероводород H2S в свободном состоянии входит в состав вулканических газов, находится в воде многих минеральных источников, а также образуется в результате разложения органических веществ.
Сероводород H2S - бесцветный, сильно ядовитый газ с неприятным запахом; Тпл = - 850С и Ткип. = - 600С. Растворимость H2S в воде невелика (при комнатной температуре в одном объеме воды растворяется 2,5 объема H2S).
В промышленности и в лаборатории сероводород получают действием сильных кислот на сульфиды металлов, например:
FeS + 2HCL=FeCl2 + H2S↑
Химические свойства сероводорода определяется его высокой восстановительной способностью и кислотными свойствами его водных растворов. Восстановительные свойства:
 Атом серы в молекуле H2S находится в низшей степени окисления (-2), поэтому
Атом серы в молекуле H2S находится в низшей степени окисления (-2), поэтому
под действием окислителей довольно легко теряет электроны и повышает свою
степень окисления:
-2ē
S0 (свободная сера)
 -6ē
-6ē
S0 S+4(SO2, H2SO3 и сульфиты)
 -8ē
-8ē
S+6 (SO3, H2SO4 и сульфаты)
Процесс окисления сероводорода зависит от активности окислителя и условий взаимодействия. Горение сероводорода на воздухе:
2H2S + O2 = 2S0 + 2H2O (при ограниченном доступе воздуха)
2. Кислородные соединения серы:
а) оксиды серы
Сера с кислородом образует несколько оксидов, но устойчивыми являются только два: SO2 - оксид серы (IV) и SO3 - оксид серы (VI). Оба имеют кислотный характер, более выраженный у SO3. Но разная степень окисления атома серы в SO2 и SO3 обуславливает существенное различие в окислительно-восстановительных свойствах этих соединений.
SO2 (сернистый газ, сернистый ангидрид) - бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более, чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объеме растворяется около 40 объемов SO2.
SO3 (серный ангидрид) - бесцветная жидкость, которая при температуре ниже 170С превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен). Растворяется в воде с выделением большого количества тепла.
Кислотные свойства.
Проявляя химические свойства типичных кислотных оксидов, сернистый и серный ангидрид взаимодействуют:
а) с основаниями, образуя два типа солей: кислые и средние:
SO2 + NaOH = NaHSO3 (гидросульфит натрия)
SO3 + NaOH = NaHSO4 (гидросульфат натрия)
SO2 + 2NaOH = Na2SO3 (сульфит натрия)
SO3 + 2NaOH = Na2SO4 (сульфат натрия)
б) с основными оксидами:
SO2 + СаО = CaSO3 (сульфит кальция)
SO3 + СаО = CaSO4 (сульфат кальция)
в) с водой:

 SO2 + H2O H2SO3 (сернистая кислота) SO3 + Н2O = H2SO4 (серная кислота)
SO2 + H2O H2SO3 (сернистая кислота) SO3 + Н2O = H2SO4 (серная кислота)
Взаимодействие SO2 с водой является обратимой реакцией, равновесие которой сильно смещено в сторону SO2 и Н2O. В свободном состоянии сернистая кислота не выделяется.
Окислительно-восстановительные свойства.
Сернистый ангидрид. В молекулах SO2 атомы серы имеют промежуточную степень окисления (+4), поэтому сернистый ангидрид сочетает в себе и окислительную, и восстановительную способность, причем последняя преобладает.
+4ē -2ē


 s°S+4s+6
s°S+4s+6
восстановление |____ | окисление
Как окислитель SO2 реагирует с более сильными восстановителями:
+4 О
SO2 + H2S = 3S + 2H2O
Окислительные свойства SO2 проявляются и в том, что он способен обесцвечивать органические красители. На этой способности основано применение сернистого газа для отбеливания шерсти, шелка и других материалов.
Как восстановитель SO2 реагирует с более сильными окислителями, например:
 t
t
2SO2 + O2 = 2SO3
SO2 + Cl2 + 2Н2O = H2SO4 + 2HC1
S+4 - 2ē →S+6 SO2 + 2HN03 = H2SO4 + 2HNO2
SO2 + H2O2 = H2SO4
Серный ангидрид. В молекулах SO3 атомы серы находятся в высшей степени окисления, поэтому этот оксид проявляет только сильные окислительные свойства, при этом он обычно восстанавливается до SO2:
+6 -2 +4
3SO3 + H2S = 4SO2 + H2O

 S+6 + 2ē→S+4 3
S+6 + 2ē→S+4 3
S2-6ē→S+4 1
Получение.
Сернистый газ: окисление серы и сероводорода:
S + О2 = SO2
2H2S + 3O2 = 2SO2 + 2Н2O
Восстановление концентрированной серной кислоты металлами:
2H2SO4 + Сu = CuSO4 + SO2↑ + 2Н2O
Обменные реакции при действии сильных кислот на сульфиты:
 so2
so2
 Na2SO3 + 2НС1 = 2NaCl + H2SO3
Na2SO3 + 2НС1 = 2NaCl + H2SO3
H2O
В промышленности сернистый газ получают при обжиге пирита:
+2-1 0 +3-2 +4 -2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Окислительно-восстановительный механизм этой реакции: в молекуле восстановителя одновременно два элемента подвергаются окислению:
 Fe2+-lē-→Fe3+
Fe2+-lē-→Fe3+
- l1ē
2S-1-10ē→2S+4
Серный ангидрид. Этот высший оксид серы образуется из SO2 только при высокой температуре и в присутствии ванадиевого катализатора:
2SO2 + O2 = 2SO3
Сернистый газ перед этой реакцией должен быть очень тщательно освобожден от примесей и влаги, которые быстро выводят катализатор из строя («отравляют»).
Сернистая кислота.
Сернистую кислоту H2SO3 получают при взаимодействии оксида серы (IV) с водой:
 SO2 + Н2O H2SO3,
SO2 + Н2O H2SO3,
неустойчива, существует только в водном растворе, при нагревании которого SO2 полностью улетучивается.
Для сернистой кислоты характерны все свойства кислот (реагирует с металлами, оксидами металлов, основаниями и солями). Кроме того, для нее характерны восстановительные свойства. Очень быстро идет окисление H2SO3 при действии таких окислителей как КМпO4, С12, Вr2:
H2SO3 + С12 + Н2O = H2SO4 + 2HC1 медленнее идет окисление кислородом воздуха:
2H2SO3 + O2 = 2H2SO4
Сернистая кислота может проявлять и окислительные свойства:
H2SO3 + 2H2S = 3S + 3H2O
Серная кислота H2SO4 - важнейшее соединение серы. Это сильная двухосновная кислота, в которой сера находится в высшей степени окисления (+6). Молекулы
H2SO4 очень прочные, не разлагаются даже при сильном нагревании. Графическая формула:


 H – O O
H – O O

 S
S
 H – O O
H – O O
Безводная H2SO4 представляет собой бесцветную масляную жидкость без запаха, при температуре ≈ 100С переходящую в твердое состояние. Ткип.= 2800С. Плотность ее почти в два раза превышает плотность воды.
Серная кислота смешивается с водой в любых соотношениях. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо постепенно и осторожно приливать в воду и перемешивать раствор. Серная кислота разъедает кожу, бумагу, ткань.
Раствор серной кислоты с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а более 70% - концентрированной серной кислотой.
Серная кислота является типичным представителем кислот и проявляет все химические свойства этого класса соединений. Наряду с этим есть очень характерная особенность, отличающая ее от большинства других кислот. Это поведение H2SO4 в окислительно-восстановительных процессах. Анион SO42-, содержащий серу в высшей степени окисления S+6, проявляет сильные окислительные свойства только в концентрированной серной кислоте. В разбавленной H2SO4 анион свою окислительную способность утрачивает.
При взаимодействии серной кислоты с веществами-восстановителями характер продуктов реакции зависит от концентрации кислоты.
Реакции с участием разбавленной серной кислоты.
В разбавленных водных растворах серная кислота находится в виде ионов, образующихся в результате электролитической диссоциации:
H2SO4 = 2Н+ + SO42-
Разбавленная серная кислота взаимодействует:
— С металлами, состоящими в ряду напряжений до водорода:
H2SO4 + Zn = H2↑ + ZnSO4
2Н+ + Zn = Н2↑ + Zn2+
— С оксидами металлов:
H2SO4 + MgO = MgSO4 + H2O
2H+ + MgO = Mg2+ + H2O
— С основаниями:
H2SO4 + 2NaOH = Na2SO4 + 2Н2O
H+ + ОН- = Н2O
— С солями более слабых и более летучих кислот:
H2SO4 + Na2CO3 = H2O + СO2↑ + Na2SO4
2Н+ + СO32- = Н2O + CO2↑
— С аммиаком:
H2SO4 + 2NH3 = (NH4)2SO4 H+ + NH3=NH4+
Все реакции с участием разбавленной серной кислоты осуществляется за счет ионов водорода Н+. Реакции с участием концентрированной серной кислоты.
Концентрированная серная кислота благодаря своему аниону SO42- окисляет многие простые и сложные вещества, которые могут выступать в роли восстановителя. При этом серная кислота восстанавливается и превращается в соединения, содержащие серу в более низких степенях окисления:

 +2ē S+4(SO2)
+2ē S+4(SO2)
S+6(H2SO4) +6ē
 S0 (свободная сера)
S0 (свободная сера)
 +8ē
+8ē
S'--2(H2S)
Образование того или иного продукта восстановления серной кислоты зависит от ряда факторов: активности восстановителя, температуры проведения реакции и степени концентрации кислоты.
Конц. H2SO4 растворяет не только металлы, стоящие в ряду активности после водорода, но и некоторые металлы, стоящие после водорода, например: Сu, Hg, Ag.
Менее активные металлы восстанавливают серную кислоту до SO2, и более активные - до свободной серы или до H2S, например:
3Zn + 4 H2SO4 = 3ZnSO4 + S0↓ + 4Н2O
4Mg + 5 H2SO4 + H2S↑+ 4H2O
Конц. H2SO4 при обычной температуре растворяет - («пассивирует») металлы Al, Cr, Fe. При нагревании эти металлы медленно растворяются, при этом образуются соли со степенью окисления металлов +3.
Окисление металлов:
S + 2 Н2SO4(конц.) = 3SO2 + 2Н2O
С + H2SO4(kohц.) = 2SO2↑ + CO2↑ +2H2O
Окисление сложных веществ:
-1 , +6 о -2
8HJ + H2SO4 = 4J2↓ + H2S↑+ 4H2O
-1 +6 0 +4
2HBr + H2SO4 = Br2 + SO2↑ + 2Н2O
-2 +6
3H2S + H2SO4 = 4So↓ + 4H2O
В промышленности серную кислоту получают из железного (серного) колчедана, или пирита. Процесс происходит в 3 стадии.
+ O2 + O2 + Н2O
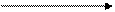
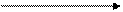
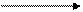 FeS SO2 SO3 H2SO4
FeS SO2 SO3 H2SO4
обжиг при t° кат., t0
Практически получают серную кислоту в виде олеума - раствора серного ангидрида SO3 в серной кислоте.
Серная кислота - очень важный продукт химической промышленности. Ее используют для получения для получении многих других химических веществ, в электрохимическом производстве, в органическом синтезе для производства лекарств, красителей, полимеров и т.д. Серную кислоту используют во всех во всех химических лабораториях как один из незаменимых реактивов.
Тиосерная кислота - H2S2CO3. Тиосерную кислоту можно рассматривать как серную кислоту, в молекуле которой один атом кислорода замещен серой:





 Н-O +6 О Н-О О
Н-O +6 О Н-О О

 S S+6
S S+6









 H – O -2 H - O
H – O -2 H - O
O S-2

 В молекуле тиосерной кислоты атомы серы имеют различную степень окисления: один атом со степенью окисления +6; другой - со степенью окисления -2.
В молекуле тиосерной кислоты атомы серы имеют различную степень окисления: один атом со степенью окисления +6; другой - со степенью окисления -2.
3. Соли кислородных кислот серы.
Соли сернистой кислоты: H2SO3 как двухосновная кислота образует два ряда солей: средние (сульфиты) и кислые (гидросульфиты). Из средних солей легко растворимы только сульфиты щелочных металлов и аммония. Растворы их имеют щелочную реакцию. Все гидросульфиты хорошо растворяются в воде, растворы их имеют слабокислую реакцию. Сульфиты и гидросульфиты в водном растворе легко окисляются до сульфатов и гидросульфатов:
2K2SO3 + O2 = 2K2SO4
2KHSO3 + O2 = 2KHSO4
В присутствии галогенов, перманганата кали, хроматов это окисление идет мгновенно:
5K2SO3 + 2KMnO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3H2O
Окисление сульфитов может происходить не только в кислой, но и в щелочной среде (продукт восстановления манганат калия К2МnO4) и нейтральной с образованием диоксида марганца МnO2.
Сульфиты легко восстанавливаются:
3Zn + Na2SO3 + 8HC1 = 3ZnCl2 + 2NaCl + H2O + H2S
Сульфиты натрия и калия применяют в фотографии, в текстильной промышленности. Сама сернистая кислота - для обесцвечивания многих красок, отбеливания шерсти, шелка, соломы.
Соли серной кислоты.
Серная кислота образует кислые соли (гидросульфаты) и средние соли (сульфаты). Наибольшее практическое значение имеют средние соли. Большинство сульфатов растворимо в воде. Мало растворим в воде сульфат кальция CaSO4, еще менее - сульфат свинца (II) PbSO4 и практически нерастворим сульфат бария BaSO4. Последняя соль нерастворима также в кислотах, поэтому образование белого осадка сульфат бария при взаимодействии катионов бария (в виде растворимых солей бария, например ВаС12) с серной кислотой и ее растворимыми солями является качественной реакцией на сульфат-ион:
SO42- +Ba2+:= BaSO4↓
Сульфат бария применяется при рентгеноскопии желудка и кишечника.
Для сульфатов характерно образование кристаллогидратов, которые часто называют купоросами: CuSO4 • 7Н2O - медный купорос, FeSO4 • 7H2O - железный купорос и т.д. при нагревании они легко выделяют кристаллизационную воду:
CuSO4 • 5Н2O → CuSO4 + 5Н2O (голубой) (белый)
Безводные сульфаты щелочных и щелочноземельных металлов не разлагаются даже при сильном нагревании. Сульфаты тяжелых металлов разлагаются при температуре ниже 10000С с образованием соответствующих оксидов, например:
FeSO4 = FeO + SO3
Из солей серной кислоты большое практическое значение имеет гипс CaSO4 • 2Н2O. При его нагревании до 150 - 170° С происходит частичная дегидратация (отщепление воды):
CaSO4 • 2Н2O = CaSO4 • 1/2 H2O+ 1/2Н2O
с образованием алебастра. При замешивании алебастра с водой в жидкое тесто оно быстро затвердевает, образуя камневидную массу, в результате протекания обратной реакции:
CaSO4 • 1/2 Н2O + 1 1/2 Н2O = CaSO4 • 2Н2O
На этом свойстве основано использование алебастра в строительстве, а также в медицинской практике для накладывания гипсовых повязок.
На практике также широко используются медный и железный купоросы (в частности, в сельском хозяйстве).
Соли тиосерной кислоты называются тиосульфатами, например Na2S2O3 -тиосульфат натрия

 Na-O О
Na-O О






 S +6
S +6
Na-O S-2

тиосульфаты являются довольно сильными восстановителями и окисляются по следующей схеме:
2S2O32- = S4O62- + 2ē
тиосульфат- ион тетратионат-ион
Взаимодействие тиосульфата натрия с йодом:
2Na2S2O3 +J2 = Na2S4O6 + 2NaJ
 J20 + 2ē = 2J- 1
J20 + 2ē = 2J- 1
2S2O32- = S4O32- = S4O62- + 2ē 1
Взаимодействие тиосульфата натрия с хлорной водой (хлор является более сильным окислителем, чем йод, поэтому тиосульфат-ион окисляется до серы):
Дата добавления: 2016-11-22; просмотров: 760;
