ТОК на аноде на катоде 5 страница
3Ag(неакт.) + 4HNO3 (разб.) = 3AgNO3 + NO↑+2H2O
4Zn(акт.) +10НNO3(разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
3Р + 5НNO3(разб.) +2Н2O = 3Н3РO4 + 5NO↑
S + 2HNO3(разб.) = H2SO4 + 2NO↑
В остальном азотная кислота имеет все свойства кислот, т.е. реагирует с оксидами металлов, основаниями и солями.
Соли азотной кислоты - нитраты, хорошо растворимы в воде; нитраты натрия, калия, кальция и аммония называются селитрами. Нитраты имеют все свойства солей. Особенности - все нитраты разлагаются при нагревании с образованием кислорода. Кроме кислорода при нагревании нитратов активных металлов (стоящих в ряду напряжении левее магния) образуются нитриты:
Ca(NO3)2 = Ca(NO2)2 + O2↑
Нитраты более тяжелых металлов (от Mg до Си включительно) разлагаются с образованием оксидов металла, оксида азота (IV) и кислорода:
2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2
Нитраты серебра, золота (после меди) при разложении дают свободный металл, оксид азота (IV) и кислород.
2AgNO3 = 2Ag + 2NO2↑ + O2↑
Особое положение занимает нитрат аммония:
NH4NO3 = N2O↑+2H2O
Водные растворы нитратов окислительными свойствами почти не обладают, но их расплавы являются сильными окислителями за счет выделения O2 и NO2.
Применение нитратов: нитраты NH4NO3, KNO3, NaNO3, Ca(NO3)2 - входят в состав удобрений; нитраты Ba(NO3)2, Sr(NO3)2, Pb(NO2)2 используют в пиротехнике; нитраты аммония, калия, и натрия применяются для производства пороха и взрывчатых веществ; нитраты Fe(NO3)3, A1(NO3)3, Cr(NO3)3 используют в текстильной промышленности как протравы при крашении тканей; азотнокислые соли ртути, серебра и висмута применяют в медицинских целях.
Вопросы для самоконтроля:
1. Дайте характеристику элемента азота в соответствии с положением в периодической системе химических элементов Д.И. Менделеева.
2. Охарактеризуйте характерные валентности и степени окисления азота. Приведите примеры соединений с различными степенями окисления азота.
3. С какими из следующих веществ будет взаимодействовать азот: O2, Н2O, Сr, Н2, С12? Напишите уравнения возможных реакций.
4. Какая связь в молекулах: NH3; NO2; N2?
5. Каковы кислотно-основные и окислительно-восстановительные свойства аммиака?
6. Выразите химическими уравнениями процесс получения азотной кислоты в промышленности.
7. Напишите уравнения разложения следующих аммонийных солей: NH4NO2, (NH4)2HPO4, (NH4)2CO3, (NH4)2S.
8. К раствору аммиака прибавили раствор сульфата алюминия. Как изменится реакция раствора? Ответ мотивируйте.
9. При кипячении 5,35 г хлорида аммония с порошком магния выделился газ. Каков объем образовавшегося газа? Ответ: 1,12 л.
10. Что называют «царской водкой»? напишите уравнение реакции взаимодействия «царской водки» с золотом. Составьте полуреакции для окислительно-восстановительного процесса.
Лекция № 22.
Тема: Строение атома фосфора, его физические и химические свойства. Аллотропия. Важнейшие соединения фосфора.
План
1. Характеристика элемента.
2. Нахождение в природе, получение и физические свойства фосфора.
Аллотропия.
3. Химические свойства фосфора.
4. Важнейшие соединения фосфора.
5. Биологическая роль фосфора и применение в медицине.
1. Характеристика элемента.
Фосфор - это неметалл семейства р-элеменов, ближайший аналог азота. Заряд атома равен +15^ пятнадцать электронов размещается на трех энергетических уровнях; электронная формула атома фосфора - ls22s22p63s23p3. -электронно-графические формулы возможных валентных состояний:
| 3d | ||||||||
| 3p | ||||||||
| 3s | ↑ | ↑ | ↑ | |||||
| ↑¯ |
основное состояние
| 3d | ||||||||
| 3p | ↑ | |||||||
| 3s | ↑ | ↑ | ↑ | |||||
| ↑ |
 P*
P*
возбужденное состояние
В своих соединениях фосфор проявляет валентности равные, III и V; наиболее характерные степени окисления: -3, 0, +3, +5. Относительная электроотрицательность фосфора значительно ниже, чем у галогенов, кислорода и азота, поэтому неметаллические свойства выражены более слабо и восстановительное активность преобладает над окислительной.
| Степень окисления | -3 | +3 | +5 | |
| Вещества | РН3 фосфин, фосфиды: Na3P, Ca3P2 | Р простое вещество | Р2O3 оксид фосфора (III), Н3РОз соли: фосфиты Na3PO3, K3PO3 | Р2О5 оксид фосфора (V), Н3РO4 соли: фосфаты Na3PO4, Са3(РO4)2 |
Наиболее устойчивы соединения фосфора со степенью окисления +5.
2. Нахождение в природе, получение и физические свойства фосфора. Аллотропия
В природе фосфор встречается только в формах, содержащих фосфат -анион РО43- . Это обусловлено тем, что для фосфора характерно образование прочных связей с кислородом: энергия связей Р - Н и Р - С гораздо ниже энергии связи Р - О, что отличает его от азота. В природе встречается в виде минералов - фосфорита 3Са3(РO4)2·Са(ОН)2 и апатита с общей формулой
3Са3(РO4)2· СаХ2, где X = F, C1.
Фосфор получают восстановлением фосфата кальция, содержащегося в апатите и фосфорите, коксом и песком в электрических печах по схеме:
t0
3Са3(РO4)2 + 5С + 3SiO2 → 3CaSiO3 + 5СО + 2Р.
Реакция протекает в две стадии: диоксид кремния вытесняет из фосфата кальция фосфорный ангидрид
Ca3(PO4)2+ 3SiO2= 3CaSiO3 + Р2О5, затем восстановление Р2О5:
Р2O5 + 5С = 2Р° + 5СО
Фосфор выделяется в виде паров, которые конденсируются в приемнике под водой.
Фосфор существует в виде нескольких аллотропных модификаций, различающихся между собой по строению молекул, физическим свойствам и химической активности.
Белый фосфор - при обычных условиях твердое вещество, похожее на воск и окрашенное примесями в желтоватый цвет. В чистом виде белый фосфор бесцветен и прозрачен. На воздухе быстро окисляется, при этом выделяется энергия в виде света, поэтому белый фосфор в темноте светится. Температура плавления 44° С, кипения 257° С. При обычной температуре легко испаряется. В воде не растворяется, но хорошо растворяется в сероуглероде и жирах. Белый Р получают при быстром охлаждении паров фосфора, его молекулы имеют состав Р4. Химическая активность его намного превосходит активность всех других, его аллотропных модификаций (самопроизвольно воспламеняется).
Белый Р очень токсичен. Это обусловлено хорошей растворимостью в жирах и, следовательно, способностью проникать через мембраны клеток, а также высокой реакционной активностью. Смертельная доза фосфора для взрослого человека составляет приблизительно 0,1 г. При длительном нагревании при t° = 400°C без доступа воздуха в атмосфере СО, белый фосфор переходит в красный. Красный фосфор открыт в 1848 году. Это неядовитый порошок темно-красного цвета, характеризуется большой плотностью, t пл. и t кип. значительно выше в сравнении с белым фосфором. Химически активность гораздо ниже: он очень медленно окисляется на воздухе, не растворяется в воде и сероуглероде, загорается при t = 260° С.
Черный фосфор получен в 1914 году из белого фосфора нагреванием при t = 400° С и очень высоком давлении, в присутствии катализатора - мельчайших капель ртути. Это темное с металлическим блеском вещество со сложными кристаллами, подобно графиту. Обладает электрической проводимостью и теплопроводностью. Не растворяется ни в одном растворителе.
Получены также и промежуточные формы: фиолетовый и коричневый (светло-красный) фосфор.
3. Химические свойства фосфора.
Имея на последнем электронном М-слое пять электронов, фосфор может проявлять степень окисления +5, -3, +3. Три основные аллотропные формы фосфора различаются химической активностью. Если белый фосфор обладает наибольшей реакционной способностью, то черный - наименьшей. Фосфор непосредственно взаимодействует со многими простыми и сложными веществами, проявляя и восстановительную и окислительную активности.
Реакции, в которых фосфор выступает как восстановитель, более многочисленны и протекают очень легко. При этом образуются соединения, содержащие фосфор в степени окисления +3 и +5. фосфор реагирует с более электроотрицательными неметаллами:
Р° - 3ē→ Р+3 Р° - 5ē→ Р+5
(при медленном окислении или (при избытке окислителя)
недостатке окислителя)
4Р + 3O2 = 2Р2O3 4Р + 5O2 = 2Р2O5
2Р + 3С12 = 2РС13 2Р + 5С12 = 2РС15
2P + 3S = P2S3 2P + 5S = P2S5
Фосфор горит в среде диоксида азота и диоксида углерода:
8P+10NO2 = 4P2O5 + 5N2
2Р + 5СO2 = Р2O5 + 5СО
Со щелочными и щелочноземельными металлами фосфор образует фосфиды, легко гидролизующиеся водой с образованием газообразного продукта - фосфина.
4000 C
Р + 3Na = Na3P (фосфид натрия)
Na3P + 3Н2O → РН3↑ (фосфин) + 3NaOH (необратимый гидролиз)
Фосфор, как окислитель, реагирует также с некоторыми более электроположительными неметаллами: As, Si, но с водородом не взаимодействует.
Азотная и концентрированная серная кислоты окисляют фосфор до высшей степени окисления (+5) с образованием ортофосфорной кислоты:
Р + 5НNO3(конц.) = Н3РO4 + 5NO2↑ + Н2O
3Р + 5HNO3 (разб.) + 2Н2O = 3Н3РО4 + 5NO↑
2Р + 5H2SO4 (конц.) = 2Н3Р04 + 5S02t + 2Н20
При t = 700° С в присутствии меди как катализатора фосфор разлагает воду:
2Р + 8Н2O = 2Н3РO4 + 5Н2↑
По сравнению с азотом и серой у фосфора проявляется тенденция к усилению метал личности.
4. Важнейшие соединения фосфора.
Фосфор образует с водородом газообразный фосфоритный водород - фосфин РН3 (гидрид водорода), бесцветный газ с чесночным запахом, малорастворим в воде, хорошо растворим в органических растворителях. РН3 очень ядовитое вещество, это одно из первых боевых отравляющих веществ. Получают его при нагревании белого фосфора с концентрированным раствором щелочи:
4Р + 3КОН + 3Н2O = РН3↑ (фосфин) + 3КН2РO2 (гипофосфит калия)
гидролизом фосфида кальция Са3Р2:
Са3Р2 + 6Н2O = 2РН3↑+ 3Са(ОН)2, а также
действием на Са3Р2 хлороводородной кислотой:
Са3Р2 + 6НС1 = 2РН3↑ + 3СаС12
Фосфин способен образовывать соли только с сильными кислотами,* при образовании солей фосфония катионом является ион фосфония РН+4
РН3 + НС1 = РН4С1 (хлорид фосфония),
соединение непрочное, водой разлогается на фосфин и НС1.
Фосфин в небольших количествах образуется в природе при гниении богатых фосфором органических соединений. Одновременно с фосфином образуется и дифосфин Р2Н4, пары которого самовоспламеняются и поджигают газообразный фосфцн. Этим объясняется появление «блуждающих огней» на болотах, кладбище.
По химическим свойствам РНз напоминает NH3, сочетая в себе слабые основные свойства и восстановительную способность.
Как восстановитель, РН3 более активен по сравнению с аммиаком. Он легко окисляется кислородом воздуха:
2РН3 + 4O2 = Р2O5 + 3Н2O.
Фосфин восстанавливает соли некоторых малоактивных металлов до свободных металлов:
РН3 + 8AgNO3 + 4Н2O = Н3РO4 + 8Ag + 8HNO3
Соединения фосфора с кислородом: Р2O3 - оксид фосфора (III) получается при медленном окислением фосфора и недостатке кислорода. Его эмпирическая формула Р20з; истинная молекулярная Р4O6.
4Р + 3O2 = 2Р2O3; на воздухе самоокисляется,
превращается в Р2О5:
Р2O3 + O2 = P2O5
Р2O3 - белое кристаллическое вещество, очень ядовитое, имеет все свойства кислотного оксида. С холодной водой образует фосфористые кислоты:
Р2O3 + Н2O = 2НРO2 (метафосфористая кислота)
НРO2 + Н2O = Н3РО3 (ортофосфористая кислота).
Фосфористый ангидрид и фосфористая кислота обладают сильными восстановительными свойствами, так как фосфор из состояния Р-3 стремится перейти в состояние Р+5.
Оксид фосфора (V) или фосфорный ангидрид P2O5 получают сжиганием фосфора в избытке кислорода:
4Р + 5O2 = 2Р3О5 (белый порошок без запаха)
Р2О5 - кислотный оксид, активно поглощает воду. С холодной водой Р2O5 образует метафосфорную кислоту (Р2О5 + Н2O = 2НРO3) и пирофосфорную (Р2O5 + 2Н2O = Н4Р2O7); при взаимодействии с горячей водой образуется ортофосфорная кислота: P2O5 + 3Н2O = 2H3PO4.
Фосфорный ангидрид может отнимать воду от различных веществ, например, от азотной, серной, хлорной кислот, от спирта, эфира, фенола и от других веществ:
2HNO3 + Р2O5 = N2O5 + 2НРO3
2НСlO4 + Р2O5 = С12O7 + 2НРO3, следовательно,
Р2О5 широко используется в качестве водопоглащающего и водоотнимающего средства.
При взаимодействии Р2О5 с основаниями и основными оксидами образуются фосфаты:
Р2O5 + 3Са(ОН)2 = Са3(РO4)2 + 3Н2O
Р2O5 + СаО = Са3(РO4)2, а так же
в зависимости от соотношения реагентов при взаимодействии со щелочами образуется:
Р2O5 + 6NaOH = 2Na3PO4 (фосфат натрия) + 3Н2O
Р2O5 + 4NaOH = 2Na2HPO4 (гидрофосфат натрия) + Н2O
Р2O5 + 2NaOH + Н2O = 2NaH2PO4 (дигидрофосфат натрия)
Н3РO4 - фосфорная кислота является трехосновной кислотой средней силы; в чистом виде это бесцветное кристаллическое вещество, хорошо растворимая в воде; tпл. = 42°С. Диссоциация происходит ступенчато:
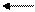
 I ступень Н3РO4 Н+ + H2PO-4 Kg = 7,5-10-3
I ступень Н3РO4 Н+ + H2PO-4 Kg = 7,5-10-3
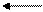
 II- ступень H2PO4- H+ + HPO2-4 Kg = 6,2- 10-8
II- ступень H2PO4- H+ + HPO2-4 Kg = 6,2- 10-8
 III- ступень НРО4 2- H+ + PO3-4 Kg = 5,0 - 10-13
III- ступень НРО4 2- H+ + PO3-4 Kg = 5,0 - 10-13
Константы II и III ступеней диссоциации очень малы, поэтому в растворе фосфорной кислоты преобладают ионы Н+ и Н2РO4-
В лаборатории Н3Р04 получают путем окисления фосфора разбавленной азотной кислотой. В промышленности Н3РO4 получают двумя способами:
— термический метод идет по схеме:
+C, + SiO2 +O2 +Н2O
 Са3(РO4)2 Р Р2O5 Н3РO4 ,
Са3(РO4)2 Р Р2O5 Н3РO4 ,
T
получают очень чистую кислоту, так как Р выделяется в газообразном состоянии, и примеси оказываются отделены, но этот способ требует больших затрат электроэнергии;
— экстракционный метод - обработка природных фосфатов, серной
кислотой:
Са3(РO4)2 + 3H2SO4 = 2Н3РO4 + 3CaSO4,
кислота загрязнена примесями. Фосфорная кислота проявляет все возможные свойства типичных кислот: взаимодействует с металлами, стоящими в ряду активности до водорода, с оксидами металлов, с основаниями, с солями более слабых кислот, с аммиаком. Анионы фосфорной кислоты не проявляют окислительных свойств, что связано с устойчивой степенью окисления +5 у фосфора.
Фосфорная кислота - неядовитое соединение, поэтому ее используют в пищевой (при изготовлении прохладительных напитков) и фармацевтической промышленности.
Являясь трехосновной кислотой средней силы, Н3РО4 образует три ряда фосфатов: одно-, двух- и трехзамещенные. Все однозамещенные (дигидрофосфаты) М1Н2РO4 растворимы в воде; из двухзамещенных (гидрофосфатов) М12НРO4 и трехзамещенных фосфатов М13РO4 растворимыми только соли щелочных металлов (где М1 - щелочной металл). Нерастворимые в воде фосфаты под действием сильных кислот могут переходить в кислые соли:
Са3(РO4)2 + 4HNO3 = 2Ca(NO3)2 + Ca(H2PO4)2 (дигидрофосфат кальция)
Кислые соли могут образовываться в результате неполной нейтрализации фосфорной кислоты
Н3РO4 + КОН = Н2O + КН2РO4 (дигидрофосфат)
Н3РO4 + 2KOH = 2Н2O + К2НРO4 (дигидрофосфат)
Соли щелочных металлов гидролизованы в водном растворе и сообщают ему щелочную реакцию:

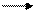 Na3PO4 + Н2O NaOH + Na2HPO4
Na3PO4 + Н2O NaOH + Na2HPO4
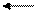
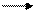 Na2HPO4 + H2O NaOH+NaH2PO4
Na2HPO4 + H2O NaOH+NaH2PO4
раствор дигидрофосфата натрия является кислым
 NaH2PO4 + H2O NaOH + H3PO4
NaH2PO4 + H2O NaOH + H3PO4
Для обнаружения иона РO43- в растворе служат реактивы: нитрат серебра и растворимые соли железа (III), образующие осадки ярко-желтого цвета и желтовато - белый:
РO43- + 3Ag+ = Ag3PO4¯ ярко-желтый
PO43- + Fe3+ = FePO4¯ желтовато-белый
Производные фосфорной кислоты имеют огромное практическое значение. Фосфор, наряду с азотом и калием, является макроэлементом, необходимым для нормального развития растений. В почву фосфор вносится в виде солей фосфорной кислоты - фосфорных удобрений: простой суперфосфат
Са3(РO4)2 + 2H2SO4 = Са(Н2РO4)2 + 2CaSO4;
дигидрофосфат кальция Са(Н2РO4)2 хорошо растворяется в воде, тогда как CaSO4 плохо растворяется и является балластом фосфорных удобрений, для чего апатит и фосфорит обрабатывают фосфорной кислотой, и получается двойной суперфосфат:
Са3(РO4)2 + 4Н3РO4 = 3Са(Н2РO4)2;
гидрофосфат кальция СаНРO4 • 2Н2O называется преципитатом, получается при взаимодействии фосфорной кислоты с гидроксидом кальция:
Н3РO4 + Са(ОН)2 = СаНРO4 • 2Н2O,
а также можно получить при обработке дигидрофосфата кальция гидрофосфатами щелочных металлов:
Са(Н2РO4)2 + Na2HPO4 = СаНРO4 + 2NaH2PO4
Дигидрофосфат калия КН2РO4 получается при сплавлении хлорида калия с фосфорной кислотой (реакция в 2 ступени):
t0
Н3РO4 + KC1 = К3РO4 + HC1 + Н2O
К3РO4 + Н2O = КН2РO4;
гидрофосфат аммония получается при нейтрализации фосфорной кислоты аммиаком:
Н3РO4 + 2NH3 = (NH4)2HPO4;
таким же способом можно получить дигидрофосфат аммония NH4H2PO4 -аммофос.
Смесь солей KH2PO4, (NH4)2HPO4, NH4H2PO4 это сложное удобрение, содержащее несколько питательных для растений элементов, химически связанных между собой.
Смесь аммофоса и хлорида калия с расплавленной аммиачной селитрой дает сложное удобрение, содержащее три питательных элемента (N2, P, К) и называется нитрофоской.
Фосфаты широко используются в промышленности и в качестве лабораторных реактивов: Са3(РO4)2 - для изготовления эмалей и матовых стекол; Na3PO4 - для очистки воды, питающей паровые котлы; кислые фосфаты используются в качестве реактивов в аналитической химии; гидрофосфат кальция употребляется в качестве добавки к кормам.
5. Биологическая роль фосфора и применение в медицине.
По содержанию в организме человека (0,95%) фосфора относится к макроэлементам. Фосфор - элемент органоген и играет исключительно важную роль в обмене веществ. В форме фосфата фосфор представляет собой необходимый компонент внутриклеточной АТФ. Он входит в состав белков (0,5 - 0,6%),нуклеиновых кислот, нуклеотидов и других биологически активных соединений. Фосфор является основой скелета животных и человека (кальций ортофосфат, гидроксиатит, зубов (гидроксиапатит, фторапатит).
Многие реакции биосинтеза осуществляются благодаря переносу фосфорных групп от высокоэнергетического акцептора к низкоэнергетическому. Фосфорная буферная система является одной из основных буферных систем крови. Живые организмы не могут обходиться без фосфора. Значение фосфора состоит и в том, что сахар и жирные кислоты не могут быть использованы клетками в качестве источников энергии без предварительного фосфорилирования.
Обмен фосфора в организме тесно связан с обменом кальция. Это подтверждается уменьшением количества неорганического фосфора при увеличении содержания кальция в крови (антагонизм).
Суточная потребность человечества в фосфоре составляет 1,3 г. Фосфор настолько распространен в пищевых продуктах, что случаи «фосфорного голода» практически неизвестны. Однако далеко не весь фосфор, содержащийся в пищевых продуктах, может всасываться, поскольку его всасывание зависит от многих факторов: рН, соотношения между содержанием кальция и фосфора в пище, наличия в пище жирных кислот, но в первую очередь от содержания витамина Д.
Целый ряд соединений фосфора используют в качестве лекарственных препаратов. Фосфорганические соединения, содержащие связь С - Р, являются сильными нервнопаралитическими ядами, входят в состав боевых отравляющих веществ.
Вопросы для самоподготовки:
1. Напишите электронную конфигурацию атома фосфора.
2. Чем обусловлена токсичность белого фосфора?
Дата добавления: 2016-11-22; просмотров: 834;
