ТОК на аноде на катоде 6 страница
3. Напишите уравнения гидролиза АТФ и АДФ.
4. Чем отличается фосфин от аммиака по кислотно-основным и окислительно-восстановительным свойствам?
5. При взаимодействии, с какими веществами фосфор вступает в роли окислителя? Восстановителя? И окислителя и восстановителя?
6. Какая масса угля, песка и апатита, содержащего 60% фосфата кальция, потребуется для получения 124 кг фосфора? Каково назначение каждого из взятых веществ?
7. Какой тип связи в соединениях: Mg3P2; P2O3; PCI3; РН3?
8. Определите молекулярную формулу одного из оксидов фосфора, содержание фосфора в котором 43,7%. Плотность по хлору пара этого оксида равна 4.
9. При помощи, каких реакций можно осуществить следующий цикл превращений:

 Р2O5 Н3РO4 Са3(РO4)2 СаНРO4 Са(Н2РO4)2
Р2O5 Н3РO4 Са3(РO4)2 СаНРO4 Са(Н2РO4)2
10. При действии хлороводородной кислоты на 26,8 г фосфида магния выделился ядовитый газ. Вычислите объем газа (н.у.).
Лекция № 23.
Тема: Общая характеристика элементов IV группы главной подгруппы периодической системы Д.И. Менделеева. Углерод и кремний.
План
1. Общая характеристика р-элементов IVA группы.
2. Строение атома углерода. Нахождение в природе. Аллотропные модификации.
3. Химические свойства углерода.
4. Кислотные соединения углерода.
5. Угольная кислота и ее соли.
6. Кремний и его соединения.
1. Общая характеристика р-элементов IVA группы.
IVA группу периодической системы элементов Д.И. Менделеева составляют углерод, кремний, германий, олово, свинец. Общая электронная
формула валентной оболочки атомов элементов IV группы: ns2 np2 . Атомы этих элементов имеют по четыре валентных электрона на s- и р- орбиталях внешнего энергетического уровня. В невозбужденном состоянии не спарены два р-электрона. Следовательно, в соединениях эти элементы могут проявлять степень окисления +2. Но в возбужденном состоянии электроны внешнего энергетического уровня приобретают конфигурацию ns1np3, и все 4 электрона оказываются не спаренными. Для углерода переход с S-подуровня на Р-подуровень можно представить следующим образом:
| ↑ | ↑ | ||
| ↑↓ | 2p2 | ||
| 2s2 | |||
| Нормальное состояние |
| ↑ | ↑ | ↑ | |
↑ 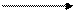
| 2p3 | ||
| 2s1 | |||
| Возбужденное состояние |
В соответствии с электронным строением возбужденного состояния элементы VI А группы могут проявлять в соединениях степень окисления +4. Радиусы атомов элементов IV А групп закономерно возрастают с увеличением порядкового номера. В этом же направлении закономерно снижается энергия ионизации и электроотрицательность.

При переходе в группе С - Si - Ge - Sn - Pb уменьшается роль не поделенной электронной пары на внешнем s-подуровне при образовании химических связей. Поэтому если для углерода, кремния и германия наиболее характерна степень окисления +4, то для свинца +2.
В живом организме углерод, кремний и германий находятся в степени окисления +4, для олова и свинца характерна степень окисления +2.
В соответствии с возрастанием размеров атомов и падением энергии ионизации при переходе от углерода к свинцу неметаллические свойства ослабевают, так как снижается способность присоединять электроэлемента группы - углерод и кремний - типичные неметаллы; германий, олово, свинец -амфотерные элементы с ярко выраженными металлическими свойствами у последнего:
Не металлические свойства ослабевают

радиус атома возрастает
Усиление металлических признаков в ряду С - Si - Ge - Sn - Pb проявляется и в химических свойствах простых веществ. В обычных условиях элементы С, Si, Ge, Sn устойчивы по отношению к воздуху и воде. Свинец же окисляется на воздухе. В электрохимическом ряду напряжений металлов Ge располагается после водопровода, a Sn и Рb перед водородом. Поэтому германий не реагирует с кислотами типа НСl и разбавленная H2SO4.
Электронное строение и размер атома, среднее значение электроотрицательности объясняют прочность связи С - С и склонность атомов углерода к образованию длинных гомоцепей:
С С С С

 / \ / \ / \ / \ /
/ \ / \ / \ / \ /
С С С С
Благодаря промежуточному значению электроотрицательности углерод образует малополярные связи с жизненноважными элементами - водородом, кислородом, азотом, серой и др. Молекулы, содержащие С - С связи, могут иметь линейное, разветвленное и циклическое строение. Различные органические молекулы, содержащие связанные между собой атомы углерода с разнообразными заместителями, образуют громадное число биомолекул.
Простейшие соединения элементов IV группы и их свойства.
| Свойства элементов | Соединения элементов | ||||
| Химический знак | С | Si | Ge | Sn | Pb |
| Распределение электронов по электронным слоям | 2.4 | 2.8.4 | 2.8.18.4 | 2.8.18. 18.4 | 2.8.18. 32.18.4 |
| Валентность | II, IV | II, IV | II, IV | II, IV | II, IV |
| Водородные соединения | СН4 углеводород (метан) | SiH4 кремнефодород (моносилан) | GeH4 германоводород (моногерман) | SnH4 гидрид олова | PbH4 гидрид свинца I |
| Оксиды типа ЭО | СО SiO GeO2 SnO PbO
 несолеобразующие амфотерные
несолеобразующие амфотерные
| ||||
| Гидроксиды типа Э(ОН)2 | - | - | Ge(OH)2 Sn(OH)2 Pb(OH)2 проявляют амфотерные свойства | ||
| Оксиды типа ЭО2 | СO2 SiO2 GeO SnO2 PbO2 кислотные амфотерные
 окислительные свойства усиливаются
окислительные свойства усиливаются
| ||||
 Гидроксиды метаформа ортоформа Гидроксиды метаформа ортоформа
| Н2СO3 - | H2SiO3 H4SiO4 | H2GeO3 H4GeO4 | H2SnO3 H4SnO4 | Н2РbO3 Н4РbO4 |
| Отрицательные ионы | CO2-3 | SiO2-3 | GeO2-3 | SnO2-3 | РbO2+3 |
| Положительные ионы | - | - | Ge2+ | Sn2+ Sn4+ | Pb2+ Pb4+ |
2. Строение атома углерода. Нахождение в природе. Аллотропные модификации.
Углерод.
Электронная формула атома углерода - 1s2 2s2 2p2 . электронно-графическая формула внешнего слоя:
| 2p | |||
| 2s | ↑ |  ↑ ↑
| |
| ↑↓ | 
|

Возможные валентности: II, IV.
Возможные степени окисления: - 4, 0, +2, +4.
В большинстве своих соединений углерод имеет валентность IV и степень окисления +4.
Так как углерод обладает большой энергией ионизации и малой энергией сродства к электрону, для него не характерно образование ионных связей. Обычно углерод образует ковалентные малополярные связи.
Наряду с обычными одинарными связями, между атомами углерода образуется также двойные и тройные связи:



 С = С -С≡С-
С = С -С≡С-
Свободный углерод - существует в природе в виде двух аллотропных модификаций - алмаза, графита, резко различающихся между собой по физическим свойствам.
Встречается в минералах в виде СаСОз, входит в состав мрамора, известняка, мела, доломита СаСО3 • MgCO; магнезита MgCO3, малахита (СuОН)2СОз, цинкового шпата ZnCO3. Углерод является главной составной частью всех животных и растительных организмов. Продуктами разложения органических веществ, содержащих углерод, являются угли, нефть. Углерод входит в состав многих природных газов, содержится в атмосфере в виде оксида углерода (IV).
Аллотропные модификации.
Алмаз - очень твердое прозрачное кристаллическое вещество. Уникальные ювелирные свойства алмаза во многом определяются высоким показателем преломления света. Должным образом отшлифованные прозрачные алмазы называются бриллиантами.
По твердости алмаз превосходит все известные в настоящее время вещества. Однако его высокая твердость сочетается с высокой хрупкостью.
Твердость алмаза объясняется строением его кристаллической решетки. В кристалле алмаза каждый углерода окружен четырьмя такими же атомами и связан с ними прочными ковалентными связями. Расстояние между всеми атомами углерода одинаковое. Кристаллическая решетка имеет тетраэдрическое строение.
В кристаллической решетке алмаза отсутствуют свободные электроны, поэтому он не обладает электро- и теплопроводностью.
Графит - мягкое темно-серое вещество с металлическим блеском. Кристаллическая решетка имеет слоистое строение.
В плоскости одного слоя атомы углерода связаны между собой прочными ковалентными связями и образуют шестичленные кольца. Отдельные слои графита, составленные из бесконечного множества таких колец, связаны друг с другом сравнительно слабо. Расстояние между слоями в кристалле графита больше расстояния между соседними атомами в одной плоскости в 2,5 раза.
Каждый атом углерода кристаллической решетки графита образует 3 прочные ковалентные связи с атомами углерода в том же слое, на что затрачивает три валентных электрона. Четвертый электрон является относительно свободным. Эти свободные электроны принимают участие в образовании связей между слоями, обобществляясь всеми атомами кристалла по типу металлической связи. Таким образом, кристаллическую решетку графита можно считать переходной между атомной и металлической решетками. Этим объясняются сравнительно высокие электро- и теплопроводность графита.
Слабо связанные между собой слои графита легко отделяются друг от друга. На этом основано применение графита для изготовления карандашей. К аллотропным модификациям углерода можно отнести и так называемый аморфный углерод, важнейшими представителями которого являются сажа, кокс и древесный уголь, из древесного угля путем его обработки перегретым паром при высокой температуре получают активированный уголь.
Искусственно получают еще одну аллотропную модификацию углерода -карбин. Это порошок черного цвета с вкраплениями более крупных частиц. В карбине атомы углерода соединяются друг с другом в длинные линейные цепи двух типов: с чередованием тройных и одинарных связей ...-С = С-С = С-С = С - С = С ... и непрерывной системой двойных связей ...=С = С = С = С = ...
3. Химические свойства углерода.
При обычной температуре углерод проявляют малую химическую активность. При нагревании реакционная способность увеличивается, особенно у графита и аморфного углерода.
Имея на внешнем электронном слое 4 электрона, атомы углерода могут их отдавать, проявляя при этом восстановительные свойства: С0 - 4ē → С+4
С другой стороны, атомы углерода могут принимать недостающие до октета 4 электрона, проявляя при этом окислительные свойства: С0 + 4ē —> С-4.
У углерода невысокая электроотрицательность (по сравнению с галогенами, кислородом, азотом и другими активными неметаллами), то окислительные свойства его выраженным значительно слабее.
1. Углерод как восстановитель.
При взаимодействии с простыми веществами, образованными более электроотрицательными неметаллами, углерод проявляет восстановительные свойства.
Предварительно нагретый углерод горит на воздухе с выделением
большого количества тепла, образуя оксид углерода (IV), или углекислый газ:
t0
С + O2 = СO2 + Q (∆Н0 = - 394 кДж/моль).
При недостатке кислорода образуется оксид углерода (II), или угарный газ
СО:
t0
2С + O2 = 2СО
Раскаленный углерод взаимодействует с серой и ее парами, образуя
сульфид серы CS2 (сероуглерод):
t0
C + 2S = CS2-Q (это эндотермическая реакция)
Сероуглерод представляет собой летучую (Т кип. = 46 С0) бесцветную жидкость с характерным запахом; является прекрасным растворителем жиров, масел, смол и т.д.
Из галогенов углерод наиболее легко взаимодействует с фтором:
С + 2F2 = CF4 тетрафторуглерод
С азотом углерод непосредственно не взаимодействует. Углерод выступает в роли восстановителя по отношению к сложным веществам:
а) при пропускании водяного пара через раскаленный уголь образуется
смесь углерода (II) с водородом (водяной газ)
t0
С + Н2O = СО ↑ + Н2↑
 водяной газ
водяной газ
б) при высокой температуре углерод восстанавливает металлы из их
оксидов:
tо
С0 + СuО = Сu0 + СО
tо
2С + PbО2 = Pb0 + 2CO
Это свойство углерода широко используется в металлургии;
Углерод взаимодействует со своим высшим оксидом СO2, переводя его в
низший оксид СО:
+4 t0 +2
С° + СO2 = 2СО
Концентрированные серная и азотная кислоты окисляют углерод до
углекислого газа:
t0
С + 2H2SO4 = СО2↑ + 2Н2O + 2SO2↑
конц.
t0
С + 4HNO3 = СО2↑ + 4NO2↑ + 2Н2O
Углерод по своей восстановительной способности близок к металлам.
2. Углерод как окислитель.
Окислительные свойства углерод проявляет по отношению к металлам и водороду.
Непосредственное взаимодействие простых веществ С и Н2 протекает с большим трудом при высоких температурах и давлении, в присутствии катализатора (платины или никеля). В результате этой обратимой реакции образуется простейший углерод - метан:
t°, P, кат.
 С0 + 2Н2 СН4
С0 + 2Н2 СН4
Несколько легче углерод взаимодействует с металлами, образуя карбиды металлов:
-4
4А1 + 3С° = А14С3 карбид алюминия
-1
Са + 2С° = СаС2 карбид кальция
Карбиды металлов активно взаимодействуют с водой и кислотами:
Аl4С3 + 12Н2O = 3СН4↑ + 4А1(ОН)3↓
А14С3 + 12НС1 = 3СН4↑ + 4А1С13
4. Кислородные соединения углерода.
В соединениях с кислородом атомы углерода проявляют, как правило, устойчивую положительную степень окисления +4.
Есть небольшая группа кислородосодержащих соединений углерода, в которых он имеет степень окисления +2. это монооксид углерода СО и его производные.
Монооксид углерода, или оксид углерода (II) СО, при обычных условиях представляет собой газ без цвета и запаха, немного легче воздуха, малорастворимый в воде. Конденсируется в жидкость при температуре - 192 °С.
Угарный газ чрезвычайно ядовит. Ядовитое действие СО обусловлено тем, что с гемоглобином крови он образует очень прочное соединение карбоксигемоглобин. При этом гемоглобин утрачивает способность связывать кислород и человек погибает от кислородного голодания. Однако, СО постепенно выводится из крови, если вдыхать чистый воздух.
Молекула СО очень прочная. На разрыв связи между атомами углерода и кислорода энергии требуется больше, чем на разрыв любой другой двухатомной молекулы. Молекула СО образована с помощью двух ковалентных связей и одной донорно-акцепторной связи. :С=О:
Моноксид углерода образуется в процессе горения угля при высокой температуре в условиях недостатка кислорода:
t0
2С + O2 = 2СО
Монооксид углерода - не солеобразующий оксид, однако он проявляет химическую активность как сильный восстановитель: С2+ - 2ё —» С+4.
Монооксид углерода реагирует с хлором на солнечном свету или в
присутствии активированного угля (катализатор), образуя очень ядовитый газ -
фосген.
+2 t 0 +4
СО + С12 = СОС12
СО горит на воздухе голубоватым пламенем с выделением большого количества теплоты, превращаясь в высший оксид СO2:
t0
2СО + O2 = 2СO2 + Q
Многие оксиды металлов восстанавливаются до свободных металлов при
нагревании в атмосфере СО:
t0
Fe2O3 + 3СО = 2Fe + 3CO2
Диоксид углерода (углекислый газ).
Диоксид углерода (оксид углерода (IV), углекислый газ, угольный ангидрид) СO2 представляет собой при обычных условиях газ без цвета и запаха, тяжелее воздуха в 1,5 раза.
При комнатной температуре под давлением около 60 атм диоксид углерода концентрируется в жидкость. При быстром испарении жидкого СO2 поглощается так много теплоты, что он превращается в твердую белую снегообразную массу («сухой лед»).
«Сухой лед» при нормальном давлении возгоняется, т.е. переходит из твердого в газообразное состояние, миную жидкую фазу.
Растворимость СO2 в воде невелика: 1 объем воды при 20 °С растворяет 0,88 объема СO2.
При понижении температуры растворимость СО2 (как и всех других газов) значительно увеличивается.
Диоксид углерода - типичный кислотный оксид. Взаимодействие с водой:
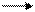 СО2 + Н2O Н2СО3 угольная кислота
СО2 + Н2O Н2СО3 угольная кислота
Эта реакция обратима, причем равновесие сильно смещено влево, т.е. лишь очень небольшое количество СО2 (менее 1%) превращается в угольную кислоту. Взаимодействие с основными оксидами:
СО2 + Na2O = Na2CO3 карбонат натрия
СO2 + СаО = СаСО3 карбонат кальция
Взаимодействие со щелочами с образованием как кислых, так и средних солей:
СO2 + NaOH = NаНСО3 гидрокарбонат натрия
СO2 + 2NaOH = Na2CO3 + Н2O карбонат натрия
Эти реакции протекают не только при пропускании СО2 в водные растворы щелочей. Твердые щелочи поглощают углекислый газ из воздуха. СО2 в реакциях с очень активными восстановителями выступает в роли окислителя:
+4 +2
СО2 + С0 = 2СО
+4
СО2 + 2Mg = С0 + 2MgO
На глубине водоемов особая группа метанобразующих бактерий переводит СО2 и Н2 в метан СН4:
+4 -
СО2 + 4Н2 = С4Н4 + 2Н2О
Ферменты бактерий
Еще одна важнейшая биохимическая реакция с участием СО2 - процесс фотосинтеза:
hv, хлорофилл
6СО2 + 6Н2О = С6Н12О6 + 6О2
Процессы окисления органических веществ (в частности, многочисленные реакции горения, дыхания, брожения) в совокупности с процессом фотосинтеза обеспечивают круговорот углекислого газа в природе.
Получение диоксида углерода:
Горение углерода и всех углеродсодержащих органических веществ:
C + O2 = CО2+Q
СН4 + 2О2 = СО2 + 2Н2О + Q
Разложение карбонатов щелочноземельных металлов:
t0
СаСО3 = СаО + СО2↑
Разложение гидрокарбонатов щелочных металлов:
t0
2NaHCO3 = Na2CO3 + СO2↑ + Н2O
Действие кислот на карбонаты металлов:
СаСО3 + 2НС1 = СO2↑ + Н2O + СаС12
Окисление углерода азотной кислотой и другими сильными окислителями:
С + 4НNO3 = СO2 + 2Н2O + 4NO2↑
5. Угольная кислота и ее соли.
Угольная кислота Н2СО3 существует только в водных растворах. Молекулы Н2СО3 подвергаются 2-х ступенчатой диссоциации. Вследствие малой концентрации угольной кислоты в водном растворе, она представляет собой очень слабый электролит:

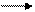 Н2СO3 Н+ + НСО- К1 = 4,3 • 10-7
Н2СO3 Н+ + НСО- К1 = 4,3 • 10-7

 НСО3 H++ СO32- К2 = 5,6 • 10-11
НСО3 H++ СO32- К2 = 5,6 • 10-11
Так как константа диссоциации по 1-ой ступени намного больше, чем по II-ой, в водных растворах преобладают гидрокарбонат-анионы НСО3-.
Любая вода на Земле (речная, морская, подземная) растворяет в себе углекислый газ из окружающей среды, причем растворимость СO2 в морской воде в несколько раз выше, чем в пресной. Равновесие в системе
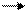
 Н2O + СO2 Н2СO3 Н+ + НСО3-
Н2O + СO2 Н2СO3 Н+ + НСО3-

 имеет очень важное значение в протекании многих природных процессов.
имеет очень важное значение в протекании многих природных процессов.
Соли угольной кислоты - карбонаты устойчивы и играют большую роль в природе и в практической деятельности человека.
Двухосновная угольная кислота образует два ряда солей: средние -карбонаты, кислые - гидрокарбонаты.
Карбонаты щелочноземельных металлов являются основой известняковых горных пород. К природным карбонатам относится также малахит, основой которого является гидрокарбонат меди (II) - (СuОН)2СO3.
В природных водах в растворенном виде присутствуют в больших количествах гидрокарбонаты щелочных и щелочноземельных металлов
Ме(НСO3)х.
Растворимость карбонатов и гидрокарбонатов в воде различна.
Растворимость важнейших карбонатов и гидрокарбонатов в воде
| Ионы | К+ | Na+ | Са2+ | Mg- | Ва2+ |
| HCO3- | м | м | р | р | р |
| СО32- | Р | Р | н | н | н |
Под действием атмосферного воздуха, содержащего СО2 и Н2O (в виде влаги или атмосферных осадков), нерастворимые карбонаты Са и Mg переходят в растворимые гидрокарбонаты и поступают в реки и моря, обусловливая жесткость воды.
СаСО3 + Н2O + СO2 = Са(НСO3)2
MgCO3 + Н2O + СO2 = Mg(HCO3)2
Химические свойства карбонатов:
Кроме карбоната щелочных металлов, остальные разлагаются с выделением СO2:
t0
СаСО3 = СаО + СO2↑
t0
MgCO3 = MgO + СO2↑
Гидрокарбонаты t0
Са(НСO3)2 = СаО + 2СO2↑ + Н2O↑
t0
2NaHCO3 = Na2CO3 + H2O↑+ CO2↑
Гидроксокарбонаты
t0
(CuOH)2CO3 = 2CuO + CO2↑ + H2O↑
Карбонаты, взаимодействуют со всеми более сильными кислотами с выделением углекислого газа:
СаСO3 + 2HC1 = СаС12 + Н2O + СO2↑
2NaHCO3 + H2SO4 = Na2SO4 + 2Н2O + 2CO2↑
Растворимые в воде карбонаты взаимодействуют с другими растворимыми солями, если среди образующихся новых солей есть нерастворимые в воде:
Na2CO3 + Ca(NO3)2 = 2NaNO3 + CaCO3↑
CO32- + Ca2+ = CaCO3↓
Растворимые в воде карбонаты, как соли слабой кислоты, подвергаются гидролизу (в основном по первой ступени):

 СO32- + Н2O НСО3- +ОН-
СO32- + Н2O НСО3- +ОН-
Дата добавления: 2016-11-22; просмотров: 954;
