ТОК на аноде на катоде 9 страница
Са(НСO3) = СаСO3¯ + СO2↑ + Н2O
При этом образуется осадок (накипь) - труднорастворимая соль карбонат кальция (или магния), и содержание ионов Са2+ и Mg2+ в воде снижается, т.е. жесткость воды уменьшается. Временную жесткость называют также карбонатной жесткостью.
Наличие в воде сульфатов и хлоридов кальция и магния обуславливает постоянную жесткость воды. Эти соли не выделяются в осадок при кипячении, и для их устранения необходимо проводить специальную химическую очистку воды.
Для устранения жесткости применяют два метода: осаждение и ионный обмен.
Для осаждения ионов Са2+ и Mg2+ наиболее широко применяют соду Nа2СО3, известь Са(ОН)3, фосфат натрия Na3PO4 и др.
Для устранения временной жесткости методов осаждения используют известковый, натронный и содовый методы:
 Са(НСO3)2 + Са(ОН)2 = 2СаСO3¯ +H2O
Са(НСO3)2 + Са(ОН)2 = 2СаСO3¯ +H2O
Са2+ + 2НСO3- + Са2+ + 2OН- = 2СаСO3¯ + 2Н2O
Mg(HCO3)2 + 2Са(ОН)2= 2СаСОэ↓ + Mg(OH)2¯ + 2Н2O известковый метод
Mg2+ + 2НСO3- + 2Са2+ + 4OН- = 2СаСO3¯ + Mg(OH)2¯ + 2Н2O

Са(НСO3)2 + 2NaOH = СаСO3¯ + Na2CO3 + 2Н2O
Са2+ + 2НСO3- + 2OН- = СаСO3¯ + СO32- + 2Н2O натронный метод
Mg(HCO3)2 + 2NaOH = MgCO3¯ + Na2CO3 + 2Н2O
Mg2+ + 2HCO3- + 2OH- = MgCO3¯ + СО32- + 2Н2O
 Ca(HCO3)2 + Na2CO3 = CaCO3¯+ 2NaHCO3
Ca(HCO3)2 + Na2CO3 = CaCO3¯+ 2NaHCO3
Са2+ + СO32- = СаСО3¯ содовый метод
Mg(HCO3)2 + Na2CO3 = MgCO3¯ + 2NaHCO3
Mg2+ + CO32- = MgCO3¯
 Для устранения постоянной жесткости используют содовый и фосфатный методы
Для устранения постоянной жесткости используют содовый и фосфатный методы
CaSO4 + Na2CO3 = CaCO3¯ + Na2SO4
Са2+ + СO32- = СаСO3¯ содовый метод
MgSO4 + Na2CO3 = MgCO3¯ + Na2SO4
Mg2+ + CO32- = MgCO3¯

3CaSO4 + 2Na3PO4 = Ca3(PO4)2¯ + 3Na2SO4
3Ca2+ + 2PO43- = Ca3(PO4)2¯ фосфатный метод
3MgSO4 + 2Na3PO4 = Mg3(PO4)2¯ + 3Na2SO4
3Mg2+ + 2PO43- = Mg3(PO4)2 ¯
В последнее время для очистки воды стаи широко применять иониты. Ионитами называются неплавкие и нерастворимые вещества, которые содержат в своей структуре функциональные группы кислотного и основного характера, способные обмениваться на ионы веществ, растворенных в воде. В зависимости от характера функциональных групп иониты могут обмениваться катионами или анионами. Первые называются катионитами (Hkt), вторые - анионитами (АnОН). При прохождении воды через катион в Н-форме ионы кальция и магния обмениваются на ионы водороды, а вода становится кислой:

 CaSO4 + 2Hkt Ca(kt)2 + H2SO4
CaSO4 + 2Hkt Ca(kt)2 + H2SO4
Такую воду нельзя применять для технических целей, т.к. она будет растворять трубы, поэтому далее эту воду пропускают через анион в ОН-форме:
 H2SO4 + 2AnOH (An)2SO4 + 2H2O
H2SO4 + 2AnOH (An)2SO4 + 2H2O
После такой последовательной очистки получается обессоленная практически нейтральная вода, которую широко применяют в технике и быту. При ионитной очистке удаляются также все остальные соли, что делает воду более пригодной для различных целей.
В случае применения ионитной очистки воды пользуются также катионитами в натриевой форме (NaKt). При пропускании воды через такие катиониты ионы кальция и магния обмениваются на ионы натрия, и вода от них очищается.
5. Биологическая роль s-элементов II А-группы. Их применение в медицине.
Бериллий находится в растениях и в организме животных ≈ 10-7%, т.е. является примесным ультрамикроэлементом. Биологическая роль бериллия изучена недостаточно. Соединения бериллия вызывают заболевания - бериллиевый рахит, бериллиоз.
Магний - общее содержание в организме 0,027%. Концентрируется в дентине и эмали зубов, костной ткани; накапливается также в поджелудочной железе, скелетных мышцах, почках, мозге, печени и сердце. Магний является внутриклеточным катионом. Входит в состав ферментативных систем.
Кальций относится к макроэлементам. Общее содержание в организме 1,4%. Основная масса кальция находится в костной и зубной тканях. Кальций выступает в качестве строительного материала в организме.
Стронций - примесный микроэлемент. Концентрируется в костях, частично замещая кальций. Важная роль в процессах костеобразования (остеогенеза). Определение содержания стронция в плазме и эритроцитах используют для диагностики и прогнозирования заболеваний лейкозом.
Барий также является примесным микроэлементом. Концентрируется преимущественно в сетчатке глаза. Биологическая роль не выяснена. Ионы бария являются токсичными для организма.
Многие соли кальция и магния находят применение в медицине. Антацидным и легким слабительным действием обладает магний карбонат основной Mg(OH)2 • 4MgCO3 · H2O - белая магнезия; магний сульфат (горькая соль) MgSO4 • 7Н2O оказывает успокаивающее действие на ЦНС. В качестве адсорбирующего и обволакивающего средства применяют тальк - 2MgSiO2 • Mg(HSiO3)2.
Антацидными и адсорбирующим действием обладает кальций карбонат СаСО3. Его назначают внутрь при повышенной кислотности желудка; кальций сульфат (жженый гипс) CaSO4 • 1/2Н2O применяют для приготовления гипсовых повязок при переломах, а также в качестве слепочного материала при протезировании зубов. Находит применение в медицине и радиоактивный изотоп 45Са. С помощью этого изотопа были изучены процессы всасывания и распределения кальция в организме, отложения его в костях и выведение при нормальной жизнедеятельности организма и различных патологиях.
В медицине применяют барий сульфат, который не подвергается гидролизу и не растворяется в соляной кислоте желудочного сока. Применяют эту соль для рентгеновской диагностики заболеваний пищеварительного тракта в качестве контрастного вещества, т.к. BaSО4 сильно поглощает рентгеновские лучи.
Вопросы для самоконтроля:
1. У каких металлов главной подгруппы II группы металлические свойства выражены в наибольшей степени?
2. С какими из следующих веществ будет взаимодействовать магний: Н2, Н2O, F2, H3PO4, КОН, NaNO3?
3. При помощи, каких реакций можно осуществить следующий цикл превращений: Ва → ВаС12→ Ва → Ва(ОН)2→ BaSO4 → Ba(HSO3)2.
4. Определите массовую долю (%) раствора, полученного при взаимодействии 4 г кальция с 20 мл воды.
5. Определите массовую долю (%) кальция в доломите по формуле СаСO3 • MgCO3.
6. Как получить Са(ОН)2 имея в наличии Н2O, ВаС12, Са, СаО?
7. При помощи, каких реакций можно осуществить следующий цикл превращений: СаСO3 → СаС12 → Ca(NO3)2→ Са3(РO4)2 → Са(Н2РO4)2.
8. Как меняется восстановительная активность в ряду Be - Ra?
9. Объясните, почему рентгеноконтрастное вещество BaSO4 принимают внутрь при рентгеновской диагностике без опасений?
10. Какие существуют способы устранения жесткости воды?
Лекция № 26.
Тема: Общая характеристика элементов I группы главной подгруппы периодической системы Д.И. Менделеева. Щелочные металлы.
План
1. Общая характеристика s-элементов I А подгруппы.
2. Нахождение в природе, получение и физические свойства щелочных металлов (на примере натрия и калия).
3. Химические свойства щелочных металлов.
4. Соединение натрия и калия.
5. Биологическая роль s-элементов I А группы, их применение в медицине.
1. Общая характеристика s-элементов I А подгруппы.
В I А-группу входят s-элементы - щелочные металлы, исключительно важные для нормальной жизнедеятельности животных и человека. Наибольшее значение для живых организмов имеют макроэлементы натрии и калии.
Электронная формула валентной оболочки атомов щелочных металлов ns1, т.е. атомы этих элементов имеют по одному валентному электрону на s-подуровне внешнего энергетического уровня. Соответственно, устойчивая степень окисления щелочных металлов равна +1.
Все элементы I A - группы очень сходны по свойствам, что объясняется однотипным строением не только валентной электронной оболочки, но и предвнешней (за исключением лития).
С ростом радиуса атома в группе Li - Na - К - Rb – Сs - Fr ослабевает связь валентного электрона с ядром. Соответственно, в этом ряду энергия ионизации атомов щелочных металлов уменьшается. Имея на валентных оболочках один электрон, расположенный на большом расстоянии от ядра, атомы щелочных металлов легко отдают электрон. Это обусловливает низкую энергию ионизации. В результате ионизации образуются катионы Э+, имеющие устойчивую электронную конфигурацию атомов благородных газов.

520 496 419 403 375
 |  |  |  |  |  |
155 189 236 248 268 280

Все щелочные металлы имеют отрицательные стандартные окислительно-восстановительные потенциалы, большие по абсолютной величине. Это характеризует их как очень сильные восстановители. По химической активности литий уступает многим металлам, что обусловлено большею энергией гидратации ионов Li по сравнению с ионами других щелочных металлов.
Вследствие незначительного поляризующего действия (устойчивая электронная структура, большие размеры, малый заряд ядра) комплексообразование для ионов щелочных металлов, особенно - для ионов К+, Rb+, Cs+, Fr+ малохарактерно.
Несмотря на общность свойств, натрий и в особенности литий отличаются от других щелочных металлов, что обусловлено существенным различием радиусов их атомов и строения электронных оболочек.
Сходство электронного строения ионов, физико-химических свойств соединений определяет близость действия щелочных металлов на биологические процессы. Но в то же время различия в электронной структуре обусловливают их разную биологическую роль. Натрий и литий накапливаются во внеклеточной жидкости, а калий, рубидий и цезий - во внутриклеточной. В следствие близких значений радиусов ионов, энергий ионизации, одинаковых координационных чисел в живых организмах натрий и литий ведут себя сходным образом - очень похожи по ферментоактивирующим свойствам. Близость свойства натрия и лития обусловливает их взаимозамещаемость в организме.
Рубидий и цезий близки по физико-химическим свойствам к иону калия, поэтому в живых организмах они ведут себя сходным образом. В изученных системах калий, рубидий и цезий являются синергистами, а с литием -
антагонистами. На сходстве рубидия и калия основано введение в организм солей калия при отравлении солями рубидия.
Натрий и калий, как правило, являются антагонистами, но в ряде случаев близость многих физико-химических свойств обусловливает их взаимозамещение в живых организмах. Например, при увеличении количества натрия в организме усиливается выведение калия почками, т.е. наступает гипокалиемия.
2. Нахождение в природе, получение и физические свойства щелочных металлов (на примере натрия и калия).
В природе Na и К в свободном виде не встречаются. Они входят в состав различных минералов: силикатов, хлоридов, нитратов, сульфатов.
К самым важным соединениям натрия относятся NaCl (поваренная или каменная соль), NaNCО3 (натриевая или чилийская селитра), Nа2СО3 (сода), Na2B4O7· 10Н2О (бура).
Соединения калия менее распространены, чем соединения натрия. Наиболее важные минералы калия: сильвин КCl, карналлит KCl·MgCl2 • 10Н2О, калийная селитра KNO3, алюмокалиевые квасцы KA1(SO4)2, сильвинит КС1 • NaCl. Присутствует калий в золе некоторых растений в виде карбоната К2СО3 (поташ).
Получение: для выделения щелочных металлов из их соединений (хлоридов или щелочей) используют электролиз расплавов. При электролизе хлорида
натрия на катоде выделяются металлический натрий, а на аноде - хлор:
700 С
 NaCl Na+ + C1-
NaCl Na+ + C1-
расплав

 катод (-): Na+ + ē Na°
катод (-): Na+ + ē Na°
 анод (+): 2Сl- - 2ē С12° 2 NaCl = 2Na + Cl2↑
анод (+): 2Сl- - 2ē С12° 2 NaCl = 2Na + Cl2↑
При электролизе расплава NaOH на катоде осаждается металлический натрий, а на аноде выделяется кислород. Чтобы щелочной металл не взаимодействовал с кислородом, катодное пространство отделено от анодного сеткой из стали.
Калий в промышленности получают из расплава по обменным реакциям
между металлическим натрием и КОН или КСl:
t0
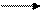 KOH + Na NaOH + K
KOH + Na NaOH + K
t0
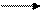 KCl + Na NaCl + K
KCl + Na NaCl + K
Калий и натрий - серебристо-белые металлы (на свежем срезе), мягкие (легко режутся ножом), легкоплавкие; хорошо проводят электрический ток; пары натрия окрашивают пламя горелки в желтый цвет; калия - в фиолетовый.
3. Химические свойства щелочных металлов.
Атомы натрия и калия легко отдают электроны, являются сильными восстановителями. Химические реакции с их участием идут очень легко, сопровождаются иногда горением и взрывом. Металлический натрий и калий взаимодействуют со многими неметаллами: очень активны по отношению к кислороду, галогенам, сере фосфору. Калий инертен по отношению к азоту, кремнию, бору.
При взаимодействии этих металлов с кислородом воздуха образуется:
горение: 2Na + O2= Na2O2 пероксид натрия
медленное окисление: 4Na + O2 = 2Na2O оксид натрия;
с галогенами:
горение: 2Na + Cl2 = 2NaCl хлорид натрия
взрыв: 2Na + F2 = 2NaF фторид натрия;
с серою: 2Na + S = Na2S сульфид натрия;
t0
с азотом: 6Na + N2 = 2Na3N нитрид натрия;
с фосфором: 3Na + Р = Na3P фосфсид натрия;
4000
с водородом: 2 Na + Н2 = 2NaH гидрид натрия, в гидридах водород электроотрицателен.
Натрий и калий бурно взаимодействует с холодной водой, вытесняя водород. Реакция идет с большим выделением теплоты. Выделившийся водород воспламеняется. С калием эта реакция протекает энергичнее:
2Na + 2Н2O = 2NaOH + H2↑
2К + 2Н2O = 2КOН + Н2↑
Натрий и калий вытесняют водород из кислот - неокислителей (НСl, Н3РO4, H2SO4 - разбавленная)
2Na + 2HC1 = 2NaCl + Н2↑, реакция протекает в две стадии:
2Na + H2O = H2↑ + 2NaOH
2NaOH + 2НС1 = 2NaCl + 2Н2O
При взаимодействии с кислотами-окислителями водород не выделяется:
5H2SO4(koh.) + 8Na = 4Na2SO4 + H2S + 4H2O
10НNO3(конц.) + 8К = 8KNO3 + N2O + 5Н2O
9НNO3(разб.) + 8Na = 8NaNO3 + NH3 + 3H2O
Натрий и калий используются как теплоносители в ядерных энергетических установках; натрий в сплаве со свинцом применяется для изготовления подшипников; в металлургии натрий служит восстановителем для получения редких металлов (Та, Zn) методом металлотермии; как катализатор в органическом синтезе; основное применение металлического калия - приготовление пероксидов, служащих для регенерации кислорода (в подводных лодках).
4. Соединение натрия и калия.
Оксид щелочных металлов Мe2O получают только при нагревании соответствующего пероксида, щелочи, нитрата или нитрита с металлом:
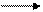 Na2O2 + 2Na 2Na2O
Na2O2 + 2Na 2Na2O
Оксиды щелочных металлов - твердые вещества, хорошо растворимые в воде. По химическим свойствам - типичные основные оксиды:
К2O + Н2O = 2КОН
Na2O + СO2 =Na2CO3
Na2O + H2SO4 = Na2SO4 + Н2O
Оксиды калия и натрия практического значения не имеют. Пероксиды имеют практическое значение, которое используется в системах жизнеобеспечения подводных лодок:
2Na2O2+ 2СO2 = 2Na2CO3 + O2
2К2O4 + 2СO2 = 2К2СO3 + 3O2
Пероксиды используются также при отбеливании тканей.
Гидроксиды натрия и калия – белые, непрозрачные, твердые кристаллические вещества очень прочные, не разлагаются при плавлении.
В лаборатории щелочи натрия и калия получают действием воды на эти металлы или на их оксиды:
2Na + 2Н2O = 2NaOH + Н2↑
К2O + Н2O = 2КОН
В промышленности получают химическим методом: на разбавленный раствор карбоната натрия действуют гидроксидом кальция:
Na2CO3 + Са(ОН)2 = 2NaOH + СаСO3,
эта реакция называется реакцией каустификации, поэтому NaOH называют каустической содой; затем нерастворимы карбонат кальция отфильтровывают, а водный раствор NaOH упаривают без доступа воздуха.
Электрохимический метод основан на электролизе насыщенных водных растворов хлоридов щелочных металлов:
2КС1 + 2Н2O = 2КОН + Н2↑+ С12↑
КОН и NaOH - сильные основания, нацело диссоциирующие в расплаве и растворе, имеют все свойства оснований:
2NaOH + SO3 = Na2SO4 + H2O
NaOH + SO3 = NaHSO4
2NaOH + H2SO4 = Na2SO4 + H2O
2NaOH + CuCl2 - Cu(OH)2¯ + 2NaCl
Щелочь взаимодействует с галогенами (хлором, бромом, йодом):
на холоду
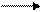 2КОН + С12 КСlO + КС1 + Н2O
2КОН + С12 КСlO + КС1 + Н2O
t0
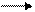 6КОН + 3С12 КСlO3 + 5КС1 + 3Н2O
6КОН + 3С12 КСlO3 + 5КС1 + 3Н2O
В щелочах растворяются некоторые металлы (Zn, Al, Sn, Cr):
Zn + 2NaOH = Na2ZnO2 + H2↑
2Cr + 2NaOH + 2H2O = 2NaCrO2 + 3H2↑
С раствором NaOH оксид углерода (II) образует соль муравьиной кислоты - формиат натрия:
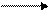 NaOH + СО HCOONa
NaOH + СО HCOONa
Хранят NaOH и КОН в закрытых сосудах, т.к. они легко вступают во взаимодействие с оксидом углерода (IV), который находится в воздухе:
2NaOH + 2СO2 = Na2CO3 + Н2O
Каустическая сода (NaOH) необходима для производства искусственных волокон, в кожевенной, текстильной промышленности; используется для омыления жиров, очистки нефтепродуктов; в щелочных аккумуляторах. КОН необходим для производства жидкого мыла.
Применение солей натрия и калия:
NaCl - (хлорид натрия) используют для производства соды, хлора, соляной кислоты, водорода; в текстильной промышленности; в металлургических процессах; в пищевой промышленности;
NaNO3 - (нитрат натрия) - азотное удобрение;
Na2CO3 - (кальцинированная сода) - в керамической, стекольной, цементной, бумажной, текстильной, мыловаренной промышленности, в медицине Na2S04 - (сульфат натрия) - применяется для обработки хлопчатобумажных тканей, в производстве соды, стекла, в медицине;
КСl - (хлорид калия) - применяется для получения соединений калия (КОН, K2CO3, K2SO4 и др.)
К2СO3 - (карбонат калия) применяется в стекольной промышленности;
KNO3 - (нитрат калия) применяется как удобрение, в производстве стекла, для приготовления черного пороха.
5. Биологическая роль s-элементов I А группы, их применение в медицине.
По содержанию в организме человека натрий (0,08%) и калий (0,23%) относятся к макроэлементам, а остальные щелочные металлы (Li, Rb, Cs) - к микроэлементам.
Литий. Содержание лития в организме человека около 70 мг. Концентрируется в печени, почках, селезенке, легких, крови, молоке. Максимальное количество - в мышцах, Биологическая роль литии как микроэлемента до конца невыяснена. Доказано, что на уровне клеточных мембран ионы лития конкурируют с ионами натрия при проникновении в клетки, что связано с большей ковалентностью соединений лития, вследствие чего они лучше растворяются в фосфолипидах.
Натрий. 44% натрия находится во внеклеточной жидкости и 9% - во внутриклеточной. Остальное количество натрия находится в костной ткани, является местом депонирования иона Na+ в организме. Около 40% натрия, содержащегося в костной ткани участвует в обменных процессах, что способствует поддержанию постоянства концентрации ионов натрия во внеклеточной жидкости.
Ионы натрия обеспечивают постоянство внутренней среды организма, участвуют в поддержании постоянного осмотического давления биожидкости (осмотического гомеостаза). В виде противоионов в соединениях с фосфорной кислотой (фосфатная буферная система Na2HPO4 + NaH2PO4) и органическими кислотами натрий обеспечивает кислотно-основное равновесие организма. Ионы натрия участвуют регуляции водного обмена и влияют на работу ферментов. В месте с ионами калия, магния, кальция, хлора ион натрия участвует в передачи нервных импульсов и поддерживает нормальную возбудимость мышечных клеток. При изменении содержании натрия в организме происходят нарушения функций нервной, сердечно-сосудистой и других систем, гладких и скелетных мышц. Натрий хлорид служит основным источником соляной кислоты для желудочного сока.
Изотонический раствор NaCl (0,9%) для инъекций вводят подкожно, внутривенно и в клизмах при обезвоживании организма и при интоксикациях; применяют для промывания для глаз; ран, слизистой оболочки носа, а также для растворения лекарственных препаратов.
Гипертонические растворы NaCl (3 - 5 - 10%) применяют наружно в виде компрессов и примочек при лечении гнойных ран (антимикробное действие); 2 - 5% раствор - для промывания желудка при отравлении AgNO3, который превращается в нетоксичный хлорид серебра: Ag+ (р) + Сl-(р) = AgCl(тв.)
Гидрокарбонат натрия NaHCO3 используют при заболеваниях сопровождающихся ацидозом. Механизм снижения кислотности -взаимодействия гидрокарбоната с кислыми подгруппами и выведение образующихся солей с мочой и выведения диоксида углерода с выдыхаемым воздухом. Используют также NaHCO3 при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки, где протекает реакция нейтрализации:
NaHCO3 + HC1 = NaCl + Н2O + СO2
Растворы NаНСО3 применяют в виде полосканий; промываний глаз, слизистых оболочек верхних дыхательных путей - антисептическое действие (водят раствор NаНСО3 проявляет слабо щелочные свойства, происходит осаждение белков и вследствие этого гибель микроорганизмов).
Натрий сульфат (глауберова соль) Na2SO4 • 10Н2О - применяют в качестве слабительного средства (соль медленно всасывается из кишечника; в результате осмоса происходит накопление воды в кишечнике, содержимое его разжижается, сокращение кишечника усиливается, происходит освобождение кишечника).
Натрий тетраборат Na2B4O7 · 10Н2О - антисептическое средство для полосканий, спринцеваний, смазываний.
Радиоактивный изотоп 24Na в качестве метки применяют для определения скорости кровотока, а также используется для лечения некоторых форм лейкемии.
Калий. Основной внутриклеточный катион. 98% находится внутри клеток, 2% - во внеклеточной жидкости. Топография калия - печень, почки, сердце, костная ткань, мышцы, кровь, мозг и т.д. Ионы калия играют важную роль в физиологических процессах - сокращении мышц, нормальном функционировании сердца, проведении нервных импульсов, обменных реакциях; важнейший активатор ферментов, находящихся внутри клетки.
Калий в большинстве случаев антогонист натрия. Ионы натрия и калия принимают участие в биокатализе, образуя смешанные комплексы типа
Дата добавления: 2016-11-22; просмотров: 1041;
