ТОК на аноде на катоде 10 страница
фермент - катион - субстрат. Примером служит образование комплексов ионов калия с антибиотиком валиномицином.
При калиевом истощении применяют хлорид калия 4-5 раз в день по 1 г.
Рубидий и цезий. Биологическая роль не выяснена. Rb - полный аналог калия, накапливаясь во внутриклеточной жидкости может замещать эквивалентное количество калия. Активирует многие те же самые ферменты,
что и калий. Радиоактивные изотопы 137Cs и 87Rb используют в радиотерапии злокачественных опухолей, а также при изучении метаболизме калия.
Франций - радиоактивный химический элемент, полученный искусственным путем. Способы избирательно накапливаться в опухолях на самых ранних стадиях их развития. Используется для диагностики онкологических заболеваний.
Вопросы для самоподготовки:
1. Строение атома щелочного металла.
2. Изменение восстановительной способности металла в главной подгруппе I группы.
3. Можно ли получить раствор калия в воде? Почему?
4. В трех склянках под слоем керосина содержится щелочные металлы: литий, натрий, калий. Как определить, в какой склянке металл?
5. Как получают щелочные металлы? Ответ подтвердите химическими уравнениями реакций.
6. Щелочной металл массой 7,8 г при реакции с водой вытесняет газ объемом 2,24 л (н.у.). Какой это металл?
7. Натрий массой 46 г растворили в 74 г воды. Вычислить массовую долю (%) полученного раствора.
8. Напишите уравнения реакций осуществления следующих превращений:
 К2СO3 КОН K2ZnO2 KNO3
К2СO3 КОН K2ZnO2 KNO3
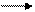

 Na2O2 Na2O NaOH NaCl NaNO3
Na2O2 Na2O NaOH NaCl NaNO3
9. С каким из перечисленных веществ будет реагировать гидроксид калия:
BaO, CO, Cl2, H3PO4, Cu(OH)2, Al(OH)3, Pb(NO3)2? Приведите уравнения
реакций.
10.Какие из перечисленных солей будут подвергаться гидролизу: KNO3, Na2S, NaHCO3, К3РO4? Напишите уравнение происходящих реакций в молекулярной в ионной формах.
Лекция № 27.
Тема: d-элементы. Побочная подгруппа I группы.
План
1. Общая характеристика d-элементов.
2. Характеристика d-элементов побочной подгруппы I группы.
3. Медь и ее соединения.
а) нахождение в природе, получение, физические свойства;
б) химические свойства меди;
в) соединения меди;
4. Химические свойства соединений серебра.
5. Химические свойства соединения золота.
6. Биологическая роль и применение в медицине d-элементов I Б группы.
1. Общая характеристика d-элементов.
К d-блоку относятся 32 элемента периодической системы, d-элементы входят в 4 - 7-й большие периоды. У атомов III Б - группы появляется первый электрон на d-орбитали. В последующих Б - группах происходит заполнение d - подуровня до 10 электронов. Строение внешних электронных оболочек атомов d - блока описывается общей формулой (п - 1) da nsB, где а = 1 - 10, и в= 1 -2.
Особенностью элементов этих периодов является непропорционально медленное возрастание атомного радиуса с возрастанием числа электронов. Это объясняется лантаноидным сжатием вследствие проникновения ns - электронов
под d - электронный слой. В результате наблюдается незначительное изменение атомных и химических свойств d - элементов с увеличением атомного номера. Сходство химических свойств проявляется в характерной особенности d-элементов образовывать комплексные соединения с разнообразными лигандами.
 Важным свойством d-элементов является переменная валентность и разнообразие степеней окисления, что связано с незавершенностью предвнешнего d-электронного слоя (кроме элементов I Б и II Б группы). В низших степенях окисления d-элементы проявляет свойства металлов. С увеличением атомного номера в группах Б металлические свойства закономерно уменьшаются:
Важным свойством d-элементов является переменная валентность и разнообразие степеней окисления, что связано с незавершенностью предвнешнего d-электронного слоя (кроме элементов I Б и II Б группы). В низших степенях окисления d-элементы проявляет свойства металлов. С увеличением атомного номера в группах Б металлические свойства закономерно уменьшаются:
Группа I Б
Сu Ag Au
|
Группа VII Б
Mn Tc Re
В растворах кислородсодержащие анионы d-элементов с высшей степенью окисления проявляют кислотные и окислительные свойства. Катионные формы низших степеней окисления характеризуются основными и восстановительными свойствами.
 d-элементы в промежуточной степени окисления проявляют амфотерные свойства. Эти закономерности можно рассматривать напримере соединений молибдена:
d-элементы в промежуточной степени окисления проявляют амфотерные свойства. Эти закономерности можно рассматривать напримере соединений молибдена:
|
Группа VI БМо (основной оксид) Мо2О3 (амфотерный оксид) МоОз(кислотный оксид)
В периоде с увеличением заряда ядра наблюдается уменьшение устойчивости соединений элементов в высших степенях окисления. Параллельно возрастной окислительно-восстановительные потенциалы этих соединений. Наибольшая окислительная способность наблюдается у диррат-ионов и перманганат-ионов. У d-элементов при нарастании относительной электроотрицательности усиливаются кислотные и неметаллические свойства.
С увеличением устойчивости соединений при движении сверху вниз в Б-группах одновременно уменьшаются их окислительные свойства.
В ходе биологической эволюции отбирались соединения элементов в промежуточных степенях окисления, которые характеризуются мягкими окислительно-восстановительными свойствами, что способствует плавному протеканию биохимических реакций. Известно, что ионы Мn2+ , Fe2+ , Co2+ при физиологических условиях не является сильными восстановителями, а ионы Сu2+ и Fe2+ практически не проявляют в организме восстановительных свойств. Дополнительное снижение реакционной способности происходит при взаимодействии этих ионов биоорганическими лигандами.
В биохимических реакциях d-элементы наиболее часто проявляют себя как металлы - комплексообразователи. Лигандами выступают биологически активные вещества органического характера или анионы неорганических кислот. Белковые молекулы образуют с d-элементами бионеорганические комплексы - кластеры или биокластеры. Белковые комплексы выполняют различные функции: транстерические доставляют к органам кислород и необходимые элементы. Координация металла идет через кислород карбоксильных групп и азот аминогрупп белка. При этом образуется устойчивое хелатное соединение. В качестве координирующего металла выступают d-элементы: кобальт, никель, железо. Примером является железосодержащий транспортный белковый комплекс - трансферрин.
Другие биокластеры выполняют аккумуляторную роль это железосодержащие белки: гемоглобин, многлобин, форритип.
Элементы: Zn, Fe, Mo, Со, Сu - входят в состав металлоферментов,
катализируют биохимические реакции, d-элементы обеспечивают в организме
запуск большинства биологических процессов, обеспечивающих
нормальную жизнедеятельность.
2. Характеристика d-элементов побочной подгруппы I группы.
К побочной подгруппе I группы периодической системы относятся переходные металлы: медь Сu, серебро Ag, золото Аu.
Атомы этих металлов на внешнем квантовом слое имеют по одному электрону, а на предпоследнем - по восемнадцать электронов. Это их отличает от щелочных металлов, которые на предпоследнем слое имеют по восемь электронов. Этим определяется различные в свойствах элементов главной подгруппы I группы от побочной.
Металлы подгруппы меди могут терять электроны с последнего и предпоследнего уровней, проявляя различные степени окисления:
Сu +1 или + 2
Ag +1 реже + 2
Аu +1 или + 3
Устойчивыми являются следующие соединения: для меди-двухвалентные, для серебра - одновалентные, для золота одно-, трехвалентные. Наиболее характерные координационные числа в этой группе 2,3,4.
Все металлы подгруппы относятся к цветным, являются тяжелыми. Они вязкие, ковкие, тягучие, легко протягиваются в проволоку.
Элементы I Б подгруппы относительно инертны. В электрохимическом ряду стоят после водорода, что проявляется в их слабой восстановительной способности. Поэтому в природе встречаются в самородном виде. Они относятся к первым металлам, которые нашел и применил древний человек. В качестве ископаемых находят соединения: Cu2O - куприт; Cu2S - халькозин; Ag2S - аргентит; AgCl - кераргитит; АuТе2 - калаверит; (Au, Ag) Te4 - сильванит.
В группе I Б восстановительные и основные свойства убывают от меди к золоту. Общая характеристика:
| Период | Элемент | Конфигурация ns и (n-1) d электронов | Орбитальный радиус | Энергия ионизации | Электроотрицательность |
| 29Cu | 3d104s1 | 119nm | 745 кДж/моль | 1,9 | |
| 47Ag | 4d105s1 | 129nm | 732 кДж/моль | 1,93 | |
| 79Au | 5d106s1 | 139nm | 891 кДж/моль | 2,54 |
С кислородом непосредственно взаимодействует только медь. С серой - медь и серебро. С галогенами медь реагирует при комнатной температуре, серебро и золото - при нагревании. Медь и серебро растворяются в разбавленной азотной кислоте и при нагревании в концентрированной серной кислоте. Золото растворяется в «царской водке» (смесь НСl и HNO3 в отношении 3:1), в концентрированной H2SeO4, в НС1 в присутствии окислителей (хлораты, нитраты, перманганаты).
3. Медь и ее соединения, а) нахождение в природе, получения, физические свойства.
В природе медь встречается в самородном состоянии. Она входит в состав минералов: халькоперит CuFeS - 34,6 %Cu; куприт Cu2O - 88,6% Сu; малахит (СuОН)2СO3 - 57,4% Сu. Большинство соединений меди входит в состав полиметаллических руд. Массовая доля меди в земной коре составляет 0,01%.
Медь получают при переработке медных руд, в которых она находится в виде оксидов, сульфидов, карбонатов.
Выплавку меди из руд, содержащих оксиды, производят путем прокаливании их с углем:
Cu2O + С = 2Сu + СО
Процесс получения меди из сульфидных руд протекает в несколько стадий: обжиг руды, где удаляется часть серы и образуется СuО:
4CuFeS2 + 13O2 = 4СuО + 2Fe2O3 + 8SO2, затем
прокаливание оксида меди (II) с сульфидом железа (II), с коксом и
песком: 12000с
2CuO + FeS + SiO2 + С = Cu2S + FeSiO3 + СО,
при этом часть FeS растворяется в сульфате меди (I) с образованием медного пека Cu2S • FeS, в котором меди соединяется до 45%; затем медный пек подвергается переработке в конвекторе с SiO2:
2Cu2S • FeS + 2SiO2 + 5O2 = 2FeSiO3 + 4SO2 + 4Cu
Полученная медь называется гериовой и содержит до 97% Сu, а также примеси Fe, Pb, Zn, Sb, Au, Ag. Дальнейшая очистка меди производится электролизом раствора соли меди. Очищаемая медь используется как анод, а катодом служит медная фольга. Электролитом является сульфат меди в серной кислоте. При электролизе на катоде оседает чистая медь.
Медь - металл красного цвета. Обладает высокой электролитической проводимостью и теплопроводностью. Плавится при температуре 10830С.
б) химические свойства меди.
Исходя из положения меди в периодической системе и строении ее атома можно предположить какие степени окисления, она способна проявлять в соединениях: она дает многочисленные устойчивые соединения со степенью окисления +2, и органическое число соединений со степенью окисления +1.
С металлами медь дает большое количество сплавов. Сплав меди с цинком - латунь; медь с никелем - мельхиор; другие сплавы меди называются бронзами - оловянная, свинцовая (применяют для изготовления подшипников; бериллиевая бронза обладает большой механической прочностью и коррозийной стойкостью и применяется в точных механизмах. Другие бронзы могут содержать Al, Mn, Fe и другие металлы.
При обычной температуре очень слабо взаимодействует с кислородом воздуха, постепенно покрываясь зеленой пленкой основной соли, которая мешает дальнейшему окислению:
2Сu + O2 + Н2O + СO2 → (СuОН)2СO3; при нагревании
2Сu + O2→СuО;
при комнатной температуре сухой хлор не реагирует с медью, однако в присутствии влаги реакция идет быстро:
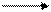 Сu + С12 СuС12;
Сu + С12 СuС12;
при нагревании также протекают реакции:

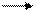 Сu + S CuS, Сu + Р→ Сu3Р2, Сu + Si Cu2Si
Сu + S CuS, Сu + Р→ Сu3Р2, Сu + Si Cu2Si
Металлическая медь растворяется в кислотах-окислителях
 3Сu + 8HNO3 (разб.) 3Cu(NO3)2 + 2NO + 4Н2O
3Сu + 8HNO3 (разб.) 3Cu(NO3)2 + 2NO + 4Н2O
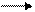 Сu + 4НNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2H2O
Сu + 4НNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2H2O
 Сu + 2 H2SO4 (конц.) CuSO4 + SO2↑ + 2H2O
Сu + 2 H2SO4 (конц.) CuSO4 + SO2↑ + 2H2O
Медь растворяется в аммиаке, образуя комплексные соединения:
 2Сu + 8NH4OH + O2 2[Cu(NH3)4](OH)2 + 6Н2O;
2Сu + 8NH4OH + O2 2[Cu(NH3)4](OH)2 + 6Н2O;
в присутствии кислорода и при высокой температуре медь взаимодействует с хлороводородом:
2Сu + 4НС1 + O2→ 2СuС12 + 2Н2O
Свыше 50% добываемой меди применяется в электротехнической промышленности. Около 30 - 40 %меди используется в металлургии для выработки сплавов. Листовую медь используют как кровельный материал для обшивки кораблей.
в) соединения меди.
Оксид меди (I) Cu2O встречается в природе в виде минерала куприта. В лаборатории получают путем взаимодействия гидроксида меди (II) с глюкозой:
2Cu(OH)2+C6H12O6 →Cu2O(красные кристаллы) + С6H12O7(глюкозовая кислота)+ 2Н2O
Cu2O - основный оксид; растворяясь в кислородсодержащих кислотах, он образует соли меди (II) и медь:
Cu2O + H2SO4→CuSO4 + Н2O + Сu,
при растворении в галогеноводородных кислотах дает соли меди (I):
Cu2O + 2HC1→2СuС1↓ + Н2O, при нагревании
нерастворимая соль растворяется в аммиаке:
CuCl + 2NH3 →[Cu(NH3)2]Cl
с восстановителями оксид меди (I) легко восстанавливается до металла:
150 С0
Cu2O + H2→2Cu + H2O
200 С0
Cu2O + СО →2Cu + СO2
Применение - в стекольной промышленности в качестве пигмента, а также для изготовления выпрямителей переменного тока.
Гидроксид меди (I) получают по реакции взаимодействие соли меди (I) со щелочами:
CuCl + NaOH→CuOH + NaCl,
соединение CuOH на устойчиво, легко окисляется до гидроксиде меди (II):
4CuOH + 2H2O + O2 = 4Cu(OH)2
Оксид меди (II) CuO можно получить: при окислении меди 2Сu + O2 = СuО; при нагревании или прокаливании гидроксида меди (II) Сu(ОН)2 = СuО + Н2O; при нагревании нитрата меди (II) 2Cu(NO3)2 + 2CuO + 4NO2↑ + O2↑ и гидроксокарбоната меди (II) (СuОН)2СО3 = 2CuO + CO2↑ + Н2O. Оксид меди (II) обладает основаниями свойствами.
Горячие растворы хлорида олова (II) и солей железа (II) восстанавливают медь из СuО до степени окисления +1:
2CuO + SnCl2 = 2CuCl + SnO2
3СuО + 2FeCl2 = 2СuС1 + СuС12 + Fe2O3
Гидроксид меди (II) Сu(ОН)2 получается в виде студнеобразного синего осадка при взаимодействии растворов солей двухвалентной меди с растворами щелочей:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu(OH)2 обладает очень слабыми амфотерными свойствами. Легко растворяется в кислотах и очень слабо в концентрированных щелочах:
Сu(ОН)2 + 2НС1 = СuС12 + 2Н2O
Сu(ОН)2 + 2КОН = К[Сu(ОН)4]
Гидроксид меди (II) может восстанавливаться до оксида меди (I) при нагревании со слабыми восстановителями:
2Cu(OH)2 + C6Hl2O6 = Cu2O + С6Н2O7 + Н2O
t С0
СuО + Н2 = Сu + Н2O
O

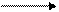
 2Сu(ОН)2 + СН3 - С Сu2O↓+ СНзСООН + 2Н2O
2Сu(ОН)2 + СН3 - С Сu2O↓+ СНзСООН + 2Н2O
H
Многие соли меди (II) гидролизуются по катиону и имеют, кислую реакцию среды. Растворимые соли диссоциируют в водном растворе с образованием гидратированных ионов [Cu(H2O)4]2+, которые имеют сине-голубой цвет, поэтому такая окраска свойственная разбавленным растворам всех солей меди (II), если они не содержат окрашенных анионов.
Образованием растворимых в воде аммиакатов объясняется растворении различных нерастворимых соединений меди в водном растворе аммиака:
CuCl + 2NH3 = [Cu(NH3)2]Cl;
Cu(OH)2 + 4NH3 + H2O = 2[Cu(NH3)2] OH;
Cu(OH)2 + 4NH3 = [Cu(NH3)4] (OH)2
Реакции образования комплексных соединений, содержащих в качестве лигандов NH3, используют как качественные для обнаружения Сu2+. Комплексы растворимы в воде и имеют ярко-синей цвет за счет ионов [Cu(NH3)4]2+.
Для меди известны также ацидокомплексы типа K2[CuCl4], Na2[Cu(CN)4] и другие.
Под действием восстановителей соли меди (II) могут восстанавливаться
до солей меди (I):
2CuSO4 + 4KJ= 2K2SO4 + 2CuJ + J2.
Из солей меди (II) имеют практическое значение сульфат меди (II) CuS04· 5Н2O для получения минеральной краски; гидроксокарбонат меди (II) (СuОН)2СОз - малахит используют как поделочный камень.
4. Химические свойства соединений серебра
Оксид серебра (I) получают при нагревании серебра с кислородом
4Ag + O2 = 2Ag2O
или обработкой растворов нитрата серебра щелочами:
2AgNO3 + 2KOH = Ag2O + 2KNO3 + H2O
Ag2O в воде растворяется незначительно, тем не менее, вследствие гидролиза растворы имеют щелочную реакцию:
Ag2O + Н2O →2Ag+ + 2OH, а в цианидных растворах превращается в комплекс:
Ag2O + 4KCN + Н2O = 2K[Ag(CN)2] + 2KOH
Ag2O - энергичный окислитель. Окисляет соли хрома (III):
3 Ag2O + 2Сг(ОН)3 + 4NaOH = 2Na2CrO4 + 6Ag + 5H2PO, а также альдегиды и галогеноводороды. Окислительные свойства серебра (I) оксида обуславливают применение его суспензии как антисептического средства.
В электрохимическом ряду нормальных окислительно-восстановительных потенциалов серебро стоит после водорода. Поэтому серебро реагирует только с концентрированными азотной и серной кислотами:
2Ag + H2SO4 = Ag2SO4 + SO2 + 2Н2O;
Ag + 2HNO3 = AgNO3 + NO2 + H2O
Большинство солей серебра мало или плохо растворимы. Практически нерастворимы галогениды, фосфаты. Плохо растворимые Ag2SO4, Ag2CO3. Растворы галогенидов серебра разлагается под действием ультрафиолетовых и рентгеновских лучей:
Hv
2AgCl = 2Ag + Cl2;
еще более чувствительны к действию УФ лучей и рентгеновских лучей кристаллы AgCl с примесью бромидов:
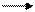 Br- + hv Br0 + ē
Br- + hv Br0 + ē
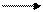 Ag++ē AgO
Ag++ē AgO

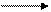 2AgBr 2Ag0 + Br20
2AgBr 2Ag0 + Br20
Это свойство галогенидов серебра использует при изготовлении светочувствительных материалов: фотопленок, рентгеновских пленок.
Нерастворимые AgCl и AgBr растворяются в аммиаке с образованием аммиакатов:
AgCl + 2NH3 = [Ag(NH3)2]Cl
Бактерицидные свойства AgCl используются в препаратах для обработки слизистых оболочек глаз. Для стерилизации и консервации пищевых продуктов применяется «серебряная» вода - обработанная кристаллами AgCl дистиллированная вода.
5. Химические свойства соединений золота.
Наиболее расплавленным соединением золота (III) является хлорид АuС13, хорошо растворимый в воде. Оксид и гидроксид золота (III) - амфотерные соединения с более выраженными кислотными свойствами. Гидроксид в воде не растворяется, но растворяется в щелочах с образованием гидроксокомплекса:
AuO(OH) + NaOH + Н2O = Na[Au(OH)4],
реагирует с кислотами с образованием ацидокомплекса:
AuO(OH) + 2H2SO4 = H[Au(SO4)2] + 2H2O
Реакция растворения золота в «царской водке» представляет собой образование комплексной кислоты:
Au + 4HC1 + HNO3 = H[AuCl4] + NO + 2H2O
6. Биологическая роль и применение в медицине d-элементов I Б группы.
Медь - биогенный элемент, общая масса меди в организме взрослого человека примерно 100 мг (0,0001%) 30% этого количества содержится в мышцах. Печень и мор такие богатые медью. Металлическая медь и ее соединения токсичны. Наиболее важными с физиологической точки зрения являются медьсодержащие белки-цитохромоксидаза и супероксиддисмутаза. Цитохромоксидаза - один из компонентов дыхательной цепи, локализованной в мембранах митохондрий. Обеспечивает клеточное дыхание, восстанавливая кислород до воды на конечном участке дыхательной цепи. Цитохромоксидаза состоит из семи белковых субъединиц и четырех связанных с ними активных цистров: двух молекул гелия, связывающих ионы железа и двух ионов меди, непосредственно связанных с белковыми субъединицами. Такая структура обеспечивает передачу четырех электронов из дыхательной цепи и осуществлении реакции:
Цитохромоксидаза
 O2 + 4Н+ + 4ē 2Н2O
O2 + 4Н+ + 4ē 2Н2O
при неполном восстановлении кислорода в дыхательнойцепи образуется супероксид - анион радикал (O2-), взаимодействие которого с органическими соединениями клетки приводит к образованию радикалов и нарушению нормального развития клетки.
Повреждающее действие супероксид - аниона предотвращается медьсоржащим ферментом супероксиддисмутазой (СОД). Этот фермент катализирует реакцию:
СОД
O2+ O2+2H+ → H2O2 +O2
образующийся при этом водородпероксид разлагается каталазой. В результате совместного действия содержании радикалов в клетке поддерживается в пределах нормы.
Ежедневно организму требуется 2,5 - 5,0 мг меди. При ее недостатке развивается медьдефицитная анемия. Медь необходима для усвоения железа, при синтезе цитохромоксидазы. При дефиците меди нарушается нормальное развитие соединительных тканей и кровеносных сосудов.
Отравления медью и ее соединениями связаны со случайной передозировкой инсектицидов, вдыханием порошка металла, заглатыванием растворов солей меди. Большую опасность представляют напитки, хранящиеся в медных сосудах без защитного покрытия стенок.
Токсическое действие соединений меди обусловлено тем, что ионы меди взаимодействуют с тиольными - SH группами (связанные) и аминогруппами -NH2 (блокирование) белков. Образуются соединения хелатного типа. Белки становятся нерастворимыми, теряют ферментативную активность, нарушается нормальная жизнедеятельность.
В качестве наружного средства применяют 0,25% -ный водный раствор CuSO4 при воспалении слизистых оболочек и конъюнктивитах. Малые дозы этого препарата могут применяться во время приема пищи для усиления эритропоэза при малокровии.
В организме взрослого человека обнаруживается около 1 мг серебра
(10-6%) и до 10 мг золота (10-5%). Антисептические свойства растворимых солей серебра известны с древних времен. Вода при хранении в серебряных сосудах не подвергается микробному загрязнению.
Сильные токсические прояваления у взрослого человека наблюдается при приеме внутрь 7 г нитрата серебра. Токсическое действие соединений серебра обусловлено тем, что ионы серебра взаимодействуют с тиольными серо – и азотсодержащими группами белков, нуклеиновых кислот и других биоорганических веществ.
В одном растворе существуют только комплексные соли золота (Na3[Au(S2O3)2] и различные тиоловые бионеорганические комплексы. Механизм токсического действия золота аналогичен механизм токсического действия соединений меди и серебра. В соответствии с общим правилом для тяжелых металлов одной группы токсичностью возрастает с увеличением атомного номера в ряду: Сu - Ag - Аu.
В медицине используются такие препараты: кристаллический серебро нитрат АgNОз(ляпис) и его водные растворы; препараты коллоидного металлического серебра - протаргол (8% Ag) и колларгол (70% Ag), которые представляют собой мелкодисперсные порошки с металлическим блеском. Препараты серебра применяют как противовоспалительные, антисептические и вяжущие средства.
Дата добавления: 2016-11-22; просмотров: 1328;
