ТОК на аноде на катоде 11 страница
В качестве эффективных противовоспалительных средств применяют препараты золота: кризанол (с 30% содержанием золота) и коллоидное золото.
Вопросы для самоконтроля:
1. Приведите примеры реакций, которые показывают уменьшение химической активности в группе Сu - Ag - Аu.
2. AgCl нерастворим в воде, но легко растворяется в водном растворе аммиака по уравнении реакции: AgCl + 2NH3→[Ag(NH3)2]Cl. Напишите это уравнение в ионной форме и классифицируйте полученную соль.
3. На основании полуреакций для окислителя и восстановителя подберите коэффициент в уравнении следующей реакции: AgNO3 + AsH3 + H2O→ Ag + H3AsO4 + HNO3.
4. Объясните причину образования зеленого налета на медных предметах. Как удалить этот налет?
5. С какими из следующих веществ будет реагировать медь: Н2О, AgNO3, MgC12, КОН. Напишите уравнения возможных реакций.
6. Напишите уравнения реакции полного гидролиза раствора CuSO4.
7. Какую роль выполняет медь, в ходя в медьсодержащие белки и ферменты?
8. Какие соединения серебра применяют в лечебных целях? Каков механизм их действия?
9. Почему при отравлениях соединениями серебра используют NaCl?
10. S-элементы группы I А и d-элементы группы I Б имеют на внешнем
11. электронном слое по одному s-электрону. В чем заключается причина того, что элементы этих групп значительно отличаются по химическим свойствам?
Лекция №28
Тема: Побочная подгруппа II группы.
План
1. Общая характеристика подгруппы.
2. Цинк: нахождение в природе, получение.
3. Химические свойства цинка: отношение к простым веществам; отношение к сложным веществам.
4. Оксид цинка.
5. Гидроксид цинка.
6. Соли цинка.
7. Биологическая роль d-элементов II Б группы и применение их соединений в медицине.
1. Общая характеристика подгруппы.
В побочную подгруппу II группы периодической системы элементов Д.И. Менделеева входят: цинк, кадмий, ртуть. Атомы этих элементов на внешнем слое имеют по два электрона (s2), на предпоследнем - 18 электронов (s2p6d10), d-подуровень у этих металлов завершен. Во всех соединениях они двухвалентны. Только ртуть может проявлять степень окисления +1. В отличие от элементов II А группы элементы II Б группы менее реакционноспособны. При обыкновенной температуре они труднее окисляются и не взаимодействуют с водой, так как их защищает плотная оксидная пленка.
Цинк и кадмий более активны, чем ртуть. В ряду напряжений они находятся до водорода, тогда как ртуть располагается после водорода. Цинк в этом ряду находится среди активных металлов и легко растворяется в кислотах и растворах щелочей. Кадмий в растворах щелочей не растворяется, а в кислотах растворяется менее энергично, чем цинк. Ртуть не растворяется ни в растворах щелочей, ни в разбавленных кислотах, а растворяется только в некоторых кислотах-окислителях.
Металлы подгруппы цинка в свободном состоянии имеют серебристо-белый цвет. Цинк при комнатной температуре хрупок, но при нагревании приобретает пластичность, легко прокатывается в листы. Кадмий хорошо куется и прокатывается в проволоку при обычных условиях, а при нагревании становится хрупким. Ртуть при обычных условиях существует в жидком состоянии.
Оксиды металлов подгруппы цинка в воде практически нерастворимы. Гидроксиды цинка и кадмия растворяются в избытке щелочи:
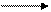 Cd(OH)2 + 2NaOH Na2[Cd(OH)4] - гидроксокадмат натрия
Cd(OH)2 + 2NaOH Na2[Cd(OH)4] - гидроксокадмат натрия
а также в водном растворе аммиака:
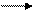 Cd(OH)2 + 4NH3 [Cd(NH3)4](OH)2
Cd(OH)2 + 4NH3 [Cd(NH3)4](OH)2
Гидроксид ртути неустойчив и разлагается уже в момент образования:
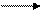 Hg(NO3)2 + 2NaOH 2NaNO3 + HgO + Н2O
Hg(NO3)2 + 2NaOH 2NaNO3 + HgO + Н2O
Цинк и кадмий используются для получения сплавов; ртуть - в электрохимической промышленности. Соли кадмия и ртути находят широкое применение: сульфид кадмия CdS - для получения желтых масляных красок и для получения цветных стекол; сульфат кадмия CdSO4 - для получения фармацевтических препаратов; хлорид ртути (II) HgCl2 - в медицине как сильнодействующее дезинфицирующее средство; в сельском хозяйстве для протравки семян; для дубления кожи; при крашении тканей; в изготовлении сухих электробатарей; нитрат ртути (II) Hg(NO3)2 - как исходный материал для получения других соединений ртути и в аналитической химии; сульфат ртути (II) HgSO4 - как катализатор в производстве некоторых органических веществ; хлорид ртути (+1) Hg2Cl2 (каломель) - в производстве электродов; как катализатор в органическом синтезе.
2. Цинк, нахождение в природе, получение.
В природе цинк встречается только в виде соединений: сульфидов, кароонатов, силикатов, которые входят в состав различных минералов.
Важнейшие минералы: ZnS, ZnCO3, Zn2SiO4, Zn2SiO4·H2O, ZnO ·A12O3.
Природные соединения цинка входят в состав полиметаллических руд, которые помимо цинка содержат соединения различных металлов: железа, меди, олова, свинца.
Металлический цинк в промышленности получают двумя методами: электролитическим и термического восстановления.
Из полиметаллических руд, содержащих кроме ZnS сульфиды других металлов, методом селективной флотации извлекают ZnS.
При обжиге концентрата сульфида цинка в обжиговых печах образуется оксид цинка:
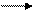 2ZnS + 3O2 2ZnO + 2SO2
2ZnS + 3O2 2ZnO + 2SO2
Металлический цинк получают также при термическом восстановлении
ZnO различными восстановителями: СО, С, Н2:
1400 С0
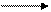 ZnO + С Zn + СО
ZnO + С Zn + СО
1100 С0
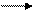 ZnO + СО Zn + СO2
ZnO + СО Zn + СO2
Для получения цинка электролитическим методом оксид цинка, полученный при обжиге сульфида цинка растворяют в разбавленной серной кислоте:
ZnO + H2SO4 = ZnSO4 + H2O
Полученный ZnSO4 подвергают электролизу:

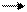 ZnSO4 Zn2+ + SO42-
ZnSO4 Zn2+ + SO42-
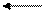
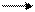 H2O H+ + OH-
H2O H+ + OH-

|

|
анод
 |  |
 Zn2+ + 2ē Zn0
Zn2+ + 2ē Zn0
2H2O - 4ē → О2↑ + 4H+
2H2O + 2ē → H2↑ + 2OH-
3. Химические свойства цинка.
Отношение к простым веществам: цинк образует сплавы с целым рядом металлов: Al, Cu, Mg, Са, Zn, Fe, Pb. Наиболее важные - латунь - сплав меди с цинком - желтая латунь; сплав 85% Zn, 5% - Al, 10% - Сu - белая латунь.
Zn взаимодействует со многими неметаллами. При обычной температуре в сухом воздухе цинк окисляется медленно. В присутствии влаги поверхность цинка покрывается прочной защитной пленкой из оксида цинка и основного карбоната (ZnO + (ZnOH)2CO3), которая предохраняет цинк от разрушения.
При нагревании до 1000°С цинк сгорает на воздухе, образуя белый порошок оксида цинка:
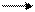 2Zn + O2 2ZnO
2Zn + O2 2ZnO
При нагревании Zn реагирует также с неметаллами, образуя соли; реакции протекают с выделением тепла:
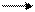 Zn + S ZnS
Zn + S ZnS
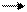 Zn + Cl2 ZnCl2
Zn + Cl2 ZnCl2
 3Zn + 2P Zn3P2
3Zn + 2P Zn3P2
Отношение к сложным веществам.
Имея на поверхности защитную пленку, цинк разлагает воду, но нагретый до температуры плавления, разлагает пары воды:
 Zn + H2O(пар) ZnO + H2
Zn + H2O(пар) ZnO + H2
Цинк взаимодействует с сероводородом при нагревании, с газообразным
аммиаком: t0
 Zn + H2S ZnS + H2↑
Zn + H2S ZnS + H2↑
 3Zn + 2NH3 Zn3N2 + 3H2↑
3Zn + 2NH3 Zn3N2 + 3H2↑
Цинк - амфотерный элемент, он растворяется в концентрированном растворе щелочи с образованием солей цинковой кислоты, а также с образованием гидроксоценката:
Zn + 2NaOH = Na2ZnO2 + H2↑
Zn +2NaOH + 2H2O =Na2[Zn(OH4)] + H2↑
Zn + 4NH4OH = [Zn(NH3)4](OH)2 + H2 + 2H2O
В ряду напряжений металлов Zn находится до водорода и вытесняет его из разбавленных кислот, кроме азотной:
Zn + 2НС1 = ZnCl2 + Н2↑
При взаимодействии с кислотами-окислителями:
4Zn + 9HNO3 (разб.) = 4Zn(NO3)2 + NH3 + 3H2O
Zn + 4HNO3 (конц.) = Zn(NO3)2 + 2NO2 + 2H2O
Zn + 2H2SO4(koh.) = ZnSO4 + SO2 + 2H2O
Металлический цинк вытесняет менее активные металлы из их солей:
Zn + CuCl2 = ZnCl2 + Сu
4. Оксид цинка - ZnO.
Оксид цинка - белый рыхлый порошок, желтеющий при нагревании, но при охлаждении снова становится белым. Плотность оксида цинка равна 5,47 г/см3, температура плавления - 1800° С.
В природе встречается в виде минерала цинката. В промышленности ZnO получают при обжиге сульфида цинка:
2ZnS + 3O2 = 2ZnO + 2SO2 + O2
В лаборатории: сжигание металлического цинка
2Zn + O2 = 2ZnO,
при прокаливании гидроксида и солей цинка
Zn(OH)2 = ZnO + Н2O
2Zn(NO3)2 = 2ZnO + 2NO2 + 3O2
Оксид цинка обладает амфотерными свойствами:
ZnO + 2НС1 = ZnCl2 + Н2O
ZnO + 2NaOH + Н2O = Na2[Zn(OH)4]
При сплавлении взаимодействует с кислотными и основными оксидами:
2ZnO + SiO2 = Zn2SiO4
ZnO + CaO = CaZnO2
Оксид цинка находит широкое применение как катализатор во многих химических процессах. Применяется для получения металлического цинка. В строительном деле - для изготовления малярной краски - цинковых белил. Входит в состав специальных сортов стекла и в производстве линолеума. Находит применение в медицине для изготовления мазей, паст, суспензий.
5. Гидроксид цинка.
При действии щелочей на растворы солей цинка выпадает белый осадок гидроксида цинка:
ZnSO4 + 2NaOH = Zn(OH)2¯ + Na2SO4,
также образуется Zn(OH)2 при обработке цинката кислотой:
Na2[Zn(OH)4] + 2 НС1 = Zn(OH)2 + 2NaCl + 2Н2O
Гидроксид цинка проявляет амфотерные свойства - легко растворяется в кислотах и щелочах с образованием солей:
Zn(OH)2 + 2НС1 = ZnCl2 + 2Н2O
Zn(OH)2 + NaOH = Na[Zn(OH)3]
или
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Растворение Zn(OH)2 происходит также в водном аммиаке вследствие образования комплексных ионов:
Zn(OH)2+ 4NH4OH = [Zn(NH3)4](OH)2 + 4Н2O
Zn(OH)2 + 4NH4OH = [Zn(NH3)4]2+ + 2OH- + 4H2O
6. Соли цинка.
Хлорид цинка ZnCl2 используется как антисептик, в гальваностегии, при травлении металлов, в химическом синтезе, как обезвоживающий реагент.
Сульфат цинка ZnS04 • 7Н2O - цинковый купорос, бесцветные прозрачные кристаллы или мелкокристаллический порошок вяжущего вкуса, без запаха. Используется для производства вискозы, в качестве микроудобрения для повышения урожайности трав, для защиты древесины от гниения, в гальваностегии (для оцинковывания предметов бытового назначения), как вяжущее и дезинфицирующее средство.
Сульфид цинка ZnS - белый аморфный порошок. При прокаливании аморфного цинка сульфата в атмосфере сероводорода образуется кристаллический фосфоресцирующий сульфид цинка, который после его облучения («дневным светом», рентгеновскими лучами или радиоактивным излучением) начинает светиться. Это свойство активированного сульфида цинка используется для изготовления экранов для рентгеновских кабинетов, для покрытия светящихся экранов телевизоров, осциллографов.
7. Биологическая роль d-элементов II Б группы и применение их
соединений в медицине.
Zn, Cd, Hg - микроэлементы. В организме взрослого человека содержится 1,8 г (0,0024%) Zn, 50 мг (7-10-5%) Cd, 13 мг (2-10"5%) Hg.
Кадмий и ртуть - примесные элементы. Около 70% ртути сосредоточено в жировой и мышечной ткани. Кадмий локализуется на 30% в почках, остальное - в печени, легких, поджелудочной железе.
Цинк - необходимый элемент всех растений и животных. В организме человек больше всего цинка в мышцах - 65%, в костях - 20%, остальное приходится на плазму крови, печень, эритроциты. Наибольшая концентрация цинка в предстательной железе.
Цинк не проявляет переменной валентности, поэтому его биокомплексы принимают участие во многих биохимических реакциях гидролиза, идущих без переноса электронов. Ион цинка входит в состав более 40 металлоферментов, катализирующих гидролизу эфиров и белков. Одним из наиболее изученных является бионеорганический комплекс цинка - фермент карбоангидраза. Белковый лиганд, связанный с ионом Zn2+, представляет активный центр фермента. Цинка в ферменте всего 0,22%. Тем не менее наличие цинка -необходимое условие каталитической активности карбоангидразы, которая обеспечивает гидратацию углекислого газа СO2:
КАТ
 СO2 + Н2O НСO-3 + Н+,
СO2 + Н2O НСO-3 + Н+,
протекание этой реакции обуславливает нормальное дыхание.
Цинк образует бионеорганический комплекс с инсулином - гормоном, регулирующим содержание сахара в крови.
Потребность человека в цинке полностью удовлетворяется пищевыми продуктами: мясными, молочными, яйцами.
При недостатке цинка в растениях нарушается белковый и углеводный обмен, тормозится синтез хлорофилла и витаминов. Дефицит цинка устраняется при использовании цинкосодержащих удобрений.
Токсичность соединений II Б группы увеличивается от цинка к ртути. Водорастворимые соединения оказывают раздражающее действие на кожу. При попадании внутрь организма вызывают отравления. Токсичны и сами металлы. При дыхании паров цинка появляется «металлическая» лихорадка. Токсичность ртути связана с агглютинацией эритроцитов, ингибированием ферментов. Токсичность кадмия связана с его родством к нуклеиновым кислотам. В результате его присоединения к ДНК нарушается его функционирование.
Хроническая интоксикация кадмием и ртутью может нарушить минерализацию костей. Это связано с близостью ионных радиусов Cd2+ (97nm), Hg2+ (110nm) и Са2+ (99nm), поэтому токсичные элементы могут замещать кальций. В результате снижается прочность костей.
Соединения Zn, Cd, Hg могут вызывать нарушение белкового обмена, что проявляется в выделении белков плазмы через почки (протеинурия). Токсические свойства элементов зависят от той химической формы, в какой они попадают в организм. Наиболее токсичны формы, которые растворяются в липидах и легко проникают через мембрану в клетку.
Использование соединений цинка и ртути в медицине основано на их вяжущем, прижигающем и антисептическим действии. В качестве глазных капель применяют 0,25% водный раствор цинк сульфата ZnSО4. В стоматологии цинк хлорид ZnCb используют для прижигания папилом, для лечения воспаленных слизистых.
Ртуть (II) хлорид HgCb (сулема) очень ядовита и ее водные растворы при больших разбавлениях (1:1000) применяют для дезинфекции. Для лечения кожных и венерических заболеваний применяют мази содержащие ртуть (II) оксид HgO и ртуть (II) сульфид HgS. Ртуть (I) хлорид Hg2Cb плохо растворяются в воде и поэтому мало ядовита. Эту соль применяют в ветеринарии как слабительное средство. Ртуть при обычных условиях - жидкий металл, который способен растворять другие металлы. При этом образуются твердые сплавы - амальгамы. В стоматологии для пломбирования зубов применяют амальгамы серебра и кадмия. Они химически инертны, легко размягчаются при нагревании и поэтому легко формуются. Жидкая ртуть используется в ряде приборов - для измерения артериального давления, в медицинских термометрах. Источники ультрафиолетового света-ртутно-кварцевые лампы медицинского назначения содержат газообразную ртуть (пары). При облучении светом этих ламп больничных помещений уничтожаются микроорганизмы, содержащиеся в воздухе. С помощью ультрафиолетовых лучей лечат кожные заболевания.
По характеру функционирования и воздействия на организм металлы II Б группы можно разделить на жизненно-необходимый элемент Zn и токсичные примесные элементы Cd и Hg.
Вопросы для самоподготовки:
1. Почему Zn, Cd и Pg не проявляют переменной валентности в своих соединениях?
2. Почему кадмий и ртуть имеют близкие орбитальные радиусы, хотя атом ртути имеет на 32 электрона больше, чем кадмий?
3. Запишите реакции, характеризующие амфотерные соединения цинка?
4. Запишите гидролиз солей ZnC12, CdCl2. Для какого из солей степень гидролиза выше и почему?
5. Напишите ступенчатую диссоциацию комплекса K2[HgJ4].
6. Назовите важнейшие ферменты, в состав которых входит цинк. Какую роль выполняет цинк, входя в состав ферментов?
7. Может ли цинк катализировать процессы, связанные с переносом электронов? Ответ мотивируйте.
8. Металлический цинк растворяется в концентрированном растворе хлорида аммония. Как это объяснить? Составьте уравнения соответствующих реакций.
9. Какие из следующих металлов - Zn, Cd, Hg - будут взаимодействовать с раствором KOHи какие с разбавленной азотной кислотой? Напишите соответствующие уравнения реакций.
10. Атомы ртути могут связываться друг с другом ковалентной связью, проявляет степень окисления +1. Для следующих ОВР напишите электронную схему и расставьте коэффициенты:
 Hg + HNО3 Hg2(NО3)2 + NO + H2О
Hg + HNО3 Hg2(NО3)2 + NO + H2О
 Hg2Cl2 + SnCl2 Hg + SnCl4
Hg2Cl2 + SnCl2 Hg + SnCl4
Лекция № 29.
Тема: Побочная подгруппа VI группы.
План
1. Общая характеристика подгруппы.
2. Хром и его соединения:
а) нахождение в природе и получение;
б) физические и химические свойства.
3. Соединения хрома
а) соединения хрома (II)
б) соединения хрома (III)
в) соединения хрома (VI)
4. Биологическая роль элементов и их применение в медицине.
1. Общая характеристика подгруппы.
Побочную подгруппу VI группы составляют элементы (переходные металлы)
- хром, молибден и вольфрам. Эти редкие металлы находятся в природе в
небольшом количестве (Сr - в земной коре 0,02%; в почве - 0,019%; в растениях
- 5-10--4%; животные - 1∙ 10-5; Мо - соответственно 1,5∙10-2%; 3∙10-4%; 2∙10-5%;
10-6∙10-5%; и W - не присутствует в земной коре; в почве -1∙10-4; в растительных
и животных организмах не наблюдается). Однако благодаря целому ряду
полезных физических и химических свойства широко применяются не только в
машиностроении и химической технологии, но и в медицинской практике.
В природе все эти металлы встречаются только в виде соединений, из которых и получают металлы. Руды сплавляют с карбонатом натрия в присутствии воздуха, и полученные оксиды восстанавливают водородом (в случае МоО3 и WO3) или алюминием (в случае Сr2Oз).
Конфигурация валентных электронов Сr и Мо - (n - 1) d5ns1; W - 5d46s2. В их атомах не достроен d - подуровень предпоследнего уровня. Атомные радиусы молибдена и вольфрама очень близки, хром - заметно отличается от них. Этим и объясняется близость свойств молибдена и вольфрама, трудность их разделения и определения при взаимном присутствии и отличает их от свойств хрома.
Сумма валентных электронов хрома, молибдена, вольфрама равна 6, что и определяет их положение в VI группе. У хрома и молибдена предпоследний электронный слой занимают 13 электронов; у вольфрама - 12. Как у большинства d - элементов этот слой неустойчив, поэтому и валентность хрома, молибдена и вольфрама непостоянна. По этой же причине соединения металлов группы VI Б характеризуются набором степеней окисления от +2 до +6.
В группе d - элементов проявляется общая тенденция: с увеличением порядкового номера увеличивается устойчивость соединений с внешней степенью окисления. Самым сильным окислителем в состоянии Э+6 является
хром; Мо проявляет слабые окислительные свойства. В низких валентных состояниях более сильные восстановительные свойства проявляет Сr+2. У ионов Мо2+ и W2+ увеличение энергии ионизации приводит к уменьшению восстановительных и металлических свойств.
Комплексные соединения данной группы элементов чаще всего имеют координационное число 6.
По строению электронной оболочки атомов с незаполненной d- орбиталью, совокупности физических и химических свойств, по склонности к образованию электроположительных ионов и координационных соединений элементы VI Б группы относятся к переходным металлам.
2. Хром и его соединения.
а) нахождение в природе и получение:
В природе хром встречается в виде окисленных минералов, например хромит FeCr2O4 или FeOCr2O3. Cодержание хрома в нем 46%; магнохромит - МgСrO4; крокоит - РbСrO4.
Для получения хрома и легированных сталей, стойких против коррозии, используются хромит железа (II):
FeCr2O4 + 4C →Fe + 2Cr + 4CO
Для производства чистого хрома хромит сначала сплавляют с содой в присутствии кислорода воздуха:
4FeCr2O4 + 8Na2CO3 + 7O2 →8Na2CrO4 + 2Fe2O3 + 8СO2
затем выделенный из сплава Na2CrO4 переводят в Na2Cr2O7:
2Na2CrO4 + H2SO4 →Na2Cr2O7 + Na2SO4 + Н2O
после чего идет его восстановление углем или серой:
Na2Cr2O7 + 2C→Cr2O3 +Na2CO3 + СО
далее оксид хрома (III) восстанавливают металлическим алюминием:
Сr2O3 + 2A1→А12O3 + 2Сr
Можно получить хром электролизом растворов и расплавов его солей.
б) физические и химические свойства.
Хром - твердый, серо-стального цвета блестящий металл. Отличается большой твердостью (режет стекло), но хрупкий, tпл. = 1200°C, tкип = 2500°С.
При обычных условиях хром устойчив ко многим химическим реагентам, что обуславливает его широкое применение в качестве защитных покрытий. Хром почти не окисляется на воздухе даже в присутствии влаги, а при нагревании окисление протекает только на поверхности, в чистом кислороде хром сгорает с образованием оксида хрома (III):
4Сr + 3O2→2Сr2O3
При нагревании реагирует с галогенами (кроме фтора), серой, азотом, фосфором, углеродом, кремнием, бором, образуя соответствию: CrF3, Cr2S3, CrN, Cr3P, Cr7C13, CrSi, CrB.
Отношение хрома к сложным веществам: с соляной и разбавленной серной кислотами реагирует медленно после растворения оксидной пленки:
2Cr + 3H2SO4→Cr2(SO4)3 + 3H2↑
В холодной азотной, концентрированной серной кислотах и «царской водке» не растворяется, т.к. происходит упрочение оксидной пленки. В горячей концентрированной серной кислоте растворяется с выделением сернистого газа:
2Cr + 6H2SO4 → Cr2(SO4)3 + 3SO2 + 6H2O
При высокой температуре хром реагирует расплавленными щелочами:
Сr + 2КОН + 2Н2O →К2СrO2 + 3Н2
Раскаленный хром реагирует с парами воды:
 2Сr + 3Н2O Сr2O3 + 3Н2
2Сr + 3Н2O Сr2O3 + 3Н2
3. Соединения хрома.
Хром образует многочисленные соединения с валентностью от двух до шести. Характерными соединениями является соединение со степенью окисления +2, +3, +6.
Дата добавления: 2016-11-22; просмотров: 1290;
