ТОК на аноде на катоде 12 страница
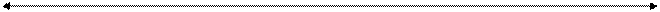
+2 +3 +6
Восстановительные Окислительные и кислотные
и основные свойства свойства
Большинство соединений хрома имеют яркую окраску самых разных цветов (хромое - цвет, окраска).
а) соединение хрома (II):
СrO - оксид хрома (II) - кристаллы красного (красно-коричневого) цвета или черный, нерастворимый в воде порошок. Соответствует гидроксид Сr(ОН)2. Гидроксид желтого (влажный) или коричневого цвета. При прокаливании на воздухе превращается в оксид хрома (III) зеленого цвета:
tо
4Сг(ОН)2 + O2 = 2Сг2O3 + 4Н2O
Катион Сr2+ - бесцветный, его безводные соли белого, а водные - синего цвета. Соли двухвалентного хрома являются энергичными восстановителями. Водный раствор хлорида хрома (II) используются в газовом анализе для количественного поглощения кислорода:
2CrCl2 + 2HgO + 3Н2O + 0,5O2 = 2HgCl2 + 2Cr(OH)3↓(грязно-зеленый осадок)
б) соединения хрома (III) многочисленны и устойчивы. Оксид хрома (III) - Сr2Oз может быть получен при взаимодействии кислорода с хромом при высокой температуре:
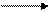 4Сr + 3O2 2Сr2O3
4Сr + 3O2 2Сr2O3
или в результате нагревания:
2Сr(ОН)3→Сг2O3 + 3Н2O, а также:
(NH4)2Cr2O7 →Cr2O3 + N2 + 4Н2O
4К2Сr2O7 →2Сr2O3 + 4К2С1O4 + 3O2↑
Оксид хрома (III) - тугоплавкое, нерастворимое в воде вещество зеленого цвета; амфотерный оксид; легко сплавляется со щелочами, со средними и кислыми солями щелочных металлов с образованием соединений хрома (III):
Сr2O3 + 2KOH →2КСrO2 + Н2O
Сr2O3 + Na2CO3 →2NaCrO2 + СO2↑
Оксид хрома (III) проявляет и восстановительные свойства:
Сr2O3 + 4КОН + КСlO3 →2К2СrO4 + KC1 + 2Н2O
Сr2O3 применяется для изготовления красок, используемых в стекольной и гончарной промышленности, в книгопечатании; входит в состав полирующих средств.
Гидроксид хрома (III) может быть получен при действии щелочей на соли хрома (III):
Cr2(SO4)3 + 6KOH→2Сr(ОН)з↓ + 3K2SO4
Образуется студнеобразный осадок зеленого цвета, обладает амфотерными свойствами, легко переходит в коллоидное состояние. Растворяясь в кислотах и щелочах образует аква- или гидроксокомплексы:
Сr(ОН)3 + 3Н3O+→ [Сr(Н2O)6]3+ (сине-фиолетовый раствор)
Сr(ОН)3 + 3ОН- →[Сr(ОН)6]3- (изумрудно-зеленый раствор)
или
Сr(ОН)3 + 3НС1 → СrС13 + 3Н2O
Сr(ОН)3 + КОН + К[Сr(ОН)4]
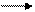 При сплавлении: Сr(ОН)3 + КОН КСrO2 + 2Н2O
При сплавлении: Сr(ОН)3 + КОН КСrO2 + 2Н2O
хромит калия
Хромиты можно получить, сплавляя Сr2Oз с оксидами других металлов и представляют собой соли хромистой кислоты НСrO2, а также с гидроксидами и карбонатами щелочных металлов. Хромиты в щелочной среде окисляются до солей хрома (VI) с образованием хроматов:
2NaCrO2 + 3С12 + 8NaOH→ 6NaCl + 2Na2CrO4 + 4Н2O
2СrС13 + 3Н2O2 + 10КОН →6KC1 + 2К2СrO4 + 8Н2O
Хромид хрома (III) СrС13 используется в качестве катализатора в органическом
синтезе.
Сульфат хрома (III) Сr2(SO4)з применяется при дублении кожи и в качестве
протравы в красильном деле.
Сульфат калия-хрома (III) KCr(SO4)2 ∙ 12Н2O - хромовые квасцы, применяются
для дубления кожи и в качестве протравы в текстильном производстве.
в) соединения хрома (VI) - это кислородсодержащие комплексы хрома.
Оксид хрома (VI) СrO3 может быть получен из концентрированных растворов хроматов и дихроматов калия при добавлении избытка концентрированной серной кислоты:
К2СrO4 + H2SO4 →СrOз + K2SO4 + Н2O
K2Cr2O7 + H2SO4 →2CrO3 + K2SO4 + H2O,
а также при обработке хромата бария избытком концентрированной азотной кислоты:
ВаСrO4 + 2HNO3 →СrO3 + Ba(NO3)2 + Н2O
СrO3 представляет собой темно-красные кристаллы, хорошо растворяющиеся в воде. Сильно разбавленные токсичные водные растворы желтого цвета содержат хромовую кислоту; концентрированный раствор СrO3 содержит двухромовую кислоту красного цвета. Хромовая и двухромовая кислоты существую только в растворе. В растворе между ними устанавливается равновесие:
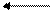
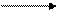 2H2CrO4 Н2Сr2O7 + Н2O
2H2CrO4 Н2Сr2O7 + Н2O
Оксид хрома (VI) - кислотный оксид с сильными окислительными свойствами.
Соли хрома (VI). Наибольшее значение имеет химия соединений хрома (VI). В щелочном растворе Сr+6 существует в форме хромат - иона СrO2-4, окрашенного в желтый цвет. В кислом растворе Сг+6 существует в форме дихромат-иона Сr2O72- окрашенного в оранжевый цвет.
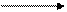 2СrO42- + 2Н+ Cr2O72- + H2O
2СrO42- + 2Н+ Cr2O72- + H2O
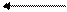 хромат дихромат
хромат дихромат
(желтый) (оранжевый)
Это равновесие может быть сдвинуто в ту или иную сторону при добавлении кислот или щелочей:
+H+
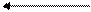
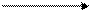 2СrO42- + Н+ Сr2O72- + Н2O
2СrO42- + Н+ Сr2O72- + Н2O
желтое OH- оранжевое
окрашивание окрашивание
Кислые растворы хроматов и дихроматов обладают сильными окислительными свойствами. При их восстановлении желтая окраска хроматов или оранжевая окраска дихроматов переходит в зеленую, обусловленную Сг3+:
2К2СrO4 + 8H2SO4 + 6FeSO4 →Cr2(SO4)3 + 2K2SO4 + 3Fe2(SO4)3 + 8H2O
Насыщенный раствор дихромата калия в концентрированной серной кислоте (хромовая смесь или «хромпик») образует СrОз которая является сильным окислителем. Хромовая смесь широко используется в химических лабораториях для мытья посуды, т.к. СrОз окисляет различные органические вещества, легко удаляет их поверхности стекла:
K2Cr2O7 + H2SO4 →2СгОз + K2SO4 + Н2O
Под действием щелочи дихромат-ионы переходят в хромат-ионы:
К2Сr2O7 + 2KOH →2К2СrO4 + Н2O
Хромат-ион СrO2-4 в щелочном растворе является более слабым окислителем, чем Сr2O72-:
СrO2-4 + 4Н2O +3ē →Сr(ОН)3 + 5OН-
При подкислении растворов хроматов ионы СrO2-4 переходят в дихромат-ионы Сr2O72-:
2К2СrO4 + H2SO4 →K2Cr2O7 + K2SO4 + Н2O
Хроматы можно получить и другим путем:
СrO3 + К2СO3 →К2СrO4 + СO2
К2Сr2O7 + К2СO3 →2К2СrO4 + СO2
Дихроматы можно получить подкислением растворов хроматов:
2К2СrO4 + 2H2SO4 →K2Cr2O7 + 2KHSO4 + Н2O
или обработкой СrOз оксидами, гидроксидами или карбонатами:
2СrO3 + 2КОН → К2Сr2O7 + Н2O
2СrO3 + К2СO3 →К2Сr2O7 + СO2
Хроматы и дихроматы щелочных металлов хорошо растворяются в воде, их применяют в аналитической химии при качественном анализе. Дихромат калия используется при дублении кожи; в производстве спичек и полиграфии для изготовления клише. Хроматами и дихроматами в смеси с другими веществами пропитывают древесину для увеличения стойкости к действию грибков и насекомых.
Окислительные свойства дихромовой кислоты лежат в основе объемного оксидиметрического метода количественного анализа - хроматометрии. В методе применяется раствор дихромата калия.
Государственная фармакопея для определения подлинности раствора водорода пероксида использовать реакцию:
К2Сr2O7 + 4Н2O2 + H2SO4 = K2SO4 + 2Н2СrO6 + 3H2O
раствор синего цвета
Cиняя окраска и подтверждает подлинность препарата Н2O2.
Соли хрома (III) и хрома (VI) токсичны для человека. Смертельная доза К2Сr2O7 для взрослого человека составляет 0,3 грамма.
4. Биологическая роль элементов и их применение в медицине.
Хром, молибден, вольфрам - микроэлементы живых организмов.
Хром активирует ряд ферментов; входит в состав инсулина, участвуя в регуляции обмена веществ в организме; входит в состав трипсина; стабилизирует структуру нуклеиновых кислот; стимулирует кроветворение и регулирует обмен холестерина в организме; проявляет противоопухолевое действие. В организме человека содержатся 6 - 12 мг хрома; суточная потребность 0,2 - 0,25 мг.
Молибден - относится к металлам жизни, является из важнейших биоэлементов. В биохимических процессах молибден участвует в степенях окисления +5 и +6. В этом состоянии он создает устойчивые оксоформы, и видимо, поэтому входит в состав ферментов, активируя их; участвует в тканевом дыхании; участвует в синтезе нуклеиновых кислот; активируя ферментов ксантинооксидазу. В крови преобладает Mo(VI), если лигандом будет кислород, то образуется устойчивые изополимолибдат-ион: MoO42- ; MoO72-; Мо7О246-.
Избыточное содержание молибдена в пище нарушает метаболизм Са2+ и РO43-, вызывая снижение прочности костей - остеопорозы.
Дефицит молибдена вызывает уменьшение активности ксантиноксидазы в тканях.
Мо - важнейший микроэлемент растений, т.к. биологически активные вещества с его участием обеспечивают мягкую фиксацию азота: превращают в аммиак или азотосодержащие продукты.
Мo - мало токсичен. Потребление с продуктами питания 0,1 - 0,3мг/сут.
Вольфрам - его роль в организме изучена недостаточно. Анионная форма вольфрама легко адсорбируется в желудочно-кишечном тракте. Металлический вольфрам и его катионные формы не адсорбируются в организме.
Сплав Сr - Со - Мо используется в хирургии и стоматологии; молибден и его сплавы применяются как детали рентгеновских трубок; из вольфрама изготовляют аноды рентгеновских трубок; сплавы вольфрама - основа экранов для защиты от гамма - лучей.
СrO3 обладает прижигающим действием
Вопросы для самоконтроля:
1. Почему увеличивается энергия ионизации от хрома к вольфраму?
2. О чем говорит увеличение электроотрицательности в группе Сr - Мо - W?
3. Почему для соединения хрома характерна переменная валентность?
4. Какие из перечисленных соединений СrС12, СrС13, Сr(ОН)3, Сr2O3, К2Сr2O7 проявляет только восстановительные свойства или только окислительные, а какие - амфотерные?
5. Какое важнейшее химическое свойство дихроматов позволяет использовать их в аналитической, клинической и санитарно-гигиенической практике, а какие в фармацевтической промышленности?
6. Составьте ионно-электронный баланс и допишите коэффициенты:
Н2С2O4 + К2Сr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + СO2 + Н2O
7. Какую роль выполняет молибден, входя в состав молибденсодержащих ферментов?
8. Осуществить превращения:
CrO3→Cr2O3→Cr→Cr2(SO4)3→CrCl3→NaCrO2
9. Для реакции Cr2(SO4)3 + Н2O2 + NaOH→Na2SO4 + Na2CrO4 + H2O
напишите электронную схему, расставьте коэффициенты незаконченную
реакцию запишите в ионной форме.
10. К подкисленному серной кислотой раствору дихромата калия добавлен раствор сульфата железа (II). Напишите уравнение происходящий реакции.
Лекция № 30.
Тема: Побочная подгруппа VII группы.
План
1. Общая характеристика подгруппы.
2. Марганец.
а) нахождение в природе и получение;
б) физические и химические свойства;
в) соединения марганца.
3. Биологическая роль марганца и его применение в медицине.
1. Общая характеристика подгруппы.
К побочной подгруппе VII группы периодической системы элементов относятся металлы марганец Мn, технеций Тс, рений Re. Из элементов этой группы наиболее распространен в природе марганец (0,03% от общего числа атомов земной коры). Технеций - радиоактивный элемент, в природе практически не встречается, получен искусственным путем в результате ядерных превращений. Рений в земной коре содержится в незначительном количестве (9-10-3%). Он относится к редким и рассеянным элементам.
Атомы этих металлов имеют электронную конфигурацию (n-l)d5ns2 , т.е. на последнем электронном уровне по 2 электрона и по пять электронов на d -орбиталях предпоследнего электронного уровня. Для марганца характерны степени окисления +2, +3, +4, +6, +7. Для остальных элементов этой группы +4, +6, +7.
 Соединения элементов побочной подгруппы в низших степенях окисления проявляют восстановительные свойства; в высших степенях окисления существуют в анионной форме (MnО4- , TcО4- , ReO4-), проявляя окислительные и кислотные свойства. В промежуточной степени окисления (IV) явно выраженная амфотерность проявляется у марганца. Это может быть объяснено уменьшением устойчивости элементов, увеличением порядкового номера, что приводит к ослаблению дифференциации кислотно-основных признаков в промежуточных степенях окисления. Поэтому именно у соединений марганца отчетливо прослеживается отмечаемая закономерность изменения кислотно-основных и окислительно-восстановительных свойств:
Соединения элементов побочной подгруппы в низших степенях окисления проявляют восстановительные свойства; в высших степенях окисления существуют в анионной форме (MnО4- , TcО4- , ReO4-), проявляя окислительные и кислотные свойства. В промежуточной степени окисления (IV) явно выраженная амфотерность проявляется у марганца. Это может быть объяснено уменьшением устойчивости элементов, увеличением порядкового номера, что приводит к ослаблению дифференциации кислотно-основных признаков в промежуточных степенях окисления. Поэтому именно у соединений марганца отчетливо прослеживается отмечаемая закономерность изменения кислотно-основных и окислительно-восстановительных свойств:
|
+2 +3 +4 +6 +7
MnO, Mn2О3 MnО2 MnО3, Мn2О7

 амфотерные
амфотерные
основные кислотные
Реакционная способность и металлические свойства уменьшаются в ряду
Мn - Тс - Re. В ряду напряжений металлов технеций и рений стоят после меди,
поэтому реагируют только с кислотами - окислителями:
3Re + 7HNO3 = 3HReO4 + 2Н2O + 7NO
При температуре 400°С они горят в амфосфере кислорода с образованием летучих оксидов Ме2O7. Желтый летучий ReF7 очень гидроксичен и растворяется в воде. Степень окисления +7 рений проявляет и при взаимодействии с некоторыми неметаллами, образуя ReF7, Re2F7. Соли перренат-иона ReO4- , растворимый в воде; еще лучше растворяются соли с анионами ТсО4-.
Технеций находит применение в медицине при радиографических обследованиях внутренних органов. Рений в основном используется в виде сплава с платиной как катализатор при переработке нефти, а также для изготовления специальных термоэлементов.
2. Марганец (Мn)
а) нахождение в природе и получение
В свободном виде марганец Мn не встречается, он входит в состав различных руд: пиролюзит МnO2, браунит Мn2O3, гаусманит Мn3О4, марганцевый шпат МnСОз. Наиболее важная из них - пиролюзит. Из пиролюзита чаще всего получают металлический марганец алюмотермическим способом: сначала его обжигают
 3МnO2 Мn3O4 + O2
3МnO2 Мn3O4 + O2
чтобы удалить кислород (в противном случае реакция МnO2 с алюминием вследствие большого выделения теплоты может стать неуправляемой), затем полученный смешанный оксид Мn3O4 смешивают с алюминиевым порошком и поджигают:
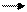 3Мn3O4 + 8Аl 9Мn + 4Аl2O3
3Мn3O4 + 8Аl 9Мn + 4Аl2O3
Однако этим способом нельзя получить марганец высокой чистоты. Чистый марганец (99,98%) получается электролизом водных растворов хлорида и сульфата марганца (II).
б) Физические и химические свойства
В чистом состоянии марганец - это серебристо-белый металл, по внешнему виду похож на железо, но в отличие от него более хрупкий и твердый. На воздухе покрывается защитной оксидной пленкой в виде пестрых пятен. Химические свойства марганца в значительной степени зависят от его чистоты.
1. Отношение к неметаллам. При высокой температуре в присутствии воздуха
или в мелкораздробленном состоянии марганец сгорает с образованием оксидов
различного состава. Энергично протекает его реакция с галогенами, образуя соли типа МnГ2. При нагревании марганец соединяется также с углеродом, азотом, фосфором, серой с образованием соответственно Mn3C, MnN3, MnP, MnS.
С водородом марганец химически не взаимодействует, но может поглощать его.
2. Отношения к сложным веществам. Марганец взаимодействует с парами
воды:
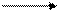 Мn + 2Н2O Мn(ОН)2 + Н2
Мn + 2Н2O Мn(ОН)2 + Н2
легко растворяется в кислотах: из НСl и разбавленной H2SO4 вытесняет водород:
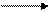 Мn + 2Н+ Мn2+ + Н2
Мn + 2Н+ Мn2+ + Н2
концентрированную H2SO4 при нагревании восстанавливает до SO2
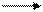 Мn + 2H2SO4 MnSO4 + SO2 + 2H2O
Мn + 2H2SO4 MnSO4 + SO2 + 2H2O
а азотную - до NO:
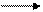 3Мn + 8HNO3 3Mn(NO3)2 + 2NO + 4Н2O
3Мn + 8HNO3 3Mn(NO3)2 + 2NO + 4Н2O
Концентрированные растворы щелочей не взаимодействуют с марганцем.
Марганец широко используется в производстве стали в качестве раскислителя и легирующего металла. Сталь, содержащая 1,5% углерода и 11 — 15% марганца, обладает большой износостойкостью и твердостью, ее применяют для изготовления дробилок, деталей экскаваторов, железнодорожных рельсов.
Сплавы марганца с медью обладают высокой прочностью и коррозийной стойкостью. Из этих сплавов делают лопатки турбин, а если к этому сплаву добавить никель, то получается марганцовистая бронза, применяемая для изготовления точных сопротивлений вследствие незначительной зависимости электрической проводимости этого сплава от температуры.
в) соединения марганца
Марганец образует соединения со степенью окисления от +1 до +7. большинству из них соответствуют оксиды. Хорошо изучены МnО - основной оксид, Мn2O3 - основной с признаками амфотерности, МnO2 - типичный кислотный оксид. Существование оксида марганца (VI) МnO3 в свободном состоянии по многим литературным источникам сомнительно, его производственные - манганаты M12MnO4, особенно щелочных металлов, широко известны.
Оксид марганца (II) МnО и оксид (III) Мn2O3 получают из оксидов с большей степенью окисления или же прокаливанием солей марганца (II), например:
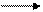 МnO2 + Н2 МnО + Н2O
МnO2 + Н2 МnО + Н2O
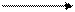 4МnO2 2Мn2O3 + O2
4МnO2 2Мn2O3 + O2
 МnСO3 МnО + СO2
МnСO3 МnО + СO2
 4MnCO3 + O2 2Мn2O3 + 4СO2
4MnCO3 + O2 2Мn2O3 + 4СO2
МnО представляет собой порошок зеленовато-серого цвета, нерастворимый в воде.
Мn2O3- черный аморфный порошок, в воде не растворяется. Как основные оксиды МnО и Мn2O3 растворяются в кислотах:
 МnО + 2НСl МnСl2 + Н2O
МnО + 2НСl МnСl2 + Н2O
 Мn2O3 + 3H2SO4 Mn2(SO4)3 + 3H2O
Мn2O3 + 3H2SO4 Mn2(SO4)3 + 3H2O
Гидроксид марганца (II) Мn(ОН)2 имеет белый цвет, гидроксид марганца (III) Мn(ОН)3 - черный. Они практически не растворяются в воде и являются очень слабыми и неустойчивыми основаниями.
Соли марганца (II) имеют розовую краску, хорошо растворяются в воде и являются устойчивыми, соли же марганца (III), как правило, неустойчивы.
Соли марганца (II) проявляют восстановительные свойства. В кислой среде
они могут окислять сильными окислителями в Н2МnО3 и НМnO4, например:
 2Mn(NO3)2 +5PbO2 + 6HNO3 2НМnO4 + 5Pb(NO3)2 + 2Н2O
2Mn(NO3)2 +5PbO2 + 6HNO3 2НМnO4 + 5Pb(NO3)2 + 2Н2O
В щелочной среде многие окислители окисляют марганец (II) в ион
марганца МnО-4:
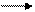 2MnSO4 + 5КВrO + 6КOН 2KMnO4 + 5KBr +2K2SO4 + ЗН2O
2MnSO4 + 5КВrO + 6КOН 2KMnO4 + 5KBr +2K2SO4 + ЗН2O
Из соединений марганца (II) практическое значение имеют несколько его солей.
Карбонат марганца (II) МnСО3 используется для приготовления масляной краски (марганцевые белила).
Сульфат марганца (II) MnSO4 применяется для окраски тканей; в сельском хозяйстве как средство, стимулирующее прорастание семян.
Нитрат марганца (II) Mn(NO3)2 - для получения чистого оксида марганца (IV), для разделения редкоземельных элементов способом фракционированной кристаллизации.
Соли марганца (III)малочисленны и малоустойчивы, как правило, окрашены в темный цвет и склонны к комплексообразованию.
Интерес представляет фиолетовый фосфат марганца (III), применяемый в качестве устойчивой на воздухе малярной краски (марганцевая фиолетовая).
Оксид марганца (IV) МnO2 (пиролюзит) - наиболее устойчивое кислородное соединение марганца, являющееся важнейшим минералом марганца. МnO2 может быть получен и искусственным путем, например нагреванием нитрата марганца (II):
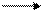 Mn(NO3)2 MnO2 + 2NO2
Mn(NO3)2 MnO2 + 2NO2
Как природный, так и неприродный МnO2 имеют цвета от серого до серо-черного. Они нерастворимы в воде. МnO2 применяется как основное сырье для получения марганца и его соединений. Широко используется как окислитель в стекольной, лакокрасочной, электротехнической промышленности. В смеси с СО пиролюзит применяют для каталитического окисления СО в противогазах.
MnO2 проявляет амфотерные свойства, одинаково основные и кислотные функции оксида марганца (IV) очень слабо выражены:
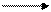 МnO2 + 4НСl МnСl4 + 2Н2O
МnO2 + 4НСl МnСl4 + 2Н2O
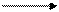 МnO2 + 2KOH К2МnO3 +Н2O
МnO2 + 2KOH К2МnO3 +Н2O
Получаются неустойчивые соли марганца (IV), распадающиеся при незначительном нагревании:
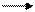 МnСl4 МnСl2 + Сl2
МnСl4 МnСl2 + Сl2
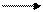 2К2МnO3 + O2 2К2МnO4
2К2МnO3 + O2 2К2МnO4
Соли марганца (VI). При сплавлении МnO2 со щелочами в присутствии окислителей образуются соли марганцовистой кислоты Н2МnO4 - манганаты, например:
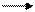 МnO2 + 2KOH +KNO3 K2MnO4 + KNO2 + Н2O
МnO2 + 2KOH +KNO3 K2MnO4 + KNO2 + Н2O
которые устойчивы только на холоду, при незначительном нагревании распадаются по схеме:
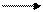 3К2МnO4 + 2Н2O МnO2 + 2KMnO4 + 4KOH
3К2МnO4 + 2Н2O МnO2 + 2KMnO4 + 4KOH
Дата добавления: 2016-11-22; просмотров: 942;
