ТОК на аноде на катоде 13 страница
Неустойчива и сама кислота Н2Мn04, которая является слабой и существует только в растворе:
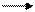 3Н2МnO4 МnO2 + 2НМnO4 + 2Н2O
3Н2МnO4 МnO2 + 2НМnO4 + 2Н2O
Все производные марганца (VI) являются сильными окислителями и легко восстанавливаются до МnO2 (в щелочной среде); проявляют и восстановительные свойства, переходя в соединения марганца (VII):
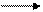 2К2МnO4 + Сl2 2KMnO4 + 2KCl
2К2МnO4 + Сl2 2KMnO4 + 2KCl
или одновременно и те и другие функции - реакции диспропорционирования:
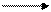 3K2MnO4 + 4HNO3 2KMnO4 + MnO2 + 4KNO3 + 2Н2O
3K2MnO4 + 4HNO3 2KMnO4 + MnO2 + 4KNO3 + 2Н2O
Широко известны соединения марганца (VII).
Оксид марганца (VII) Мn2O7 может быть получен при действии холодной серной кислоты на КМnO4:
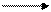 2KMnO4 + H2SO4 K2SO4 + Mn2O7 + Н2O
2KMnO4 + H2SO4 K2SO4 + Mn2O7 + Н2O
Mn2O7 представляет собой темно-зеленую маслянистую жидкость, разлагающуюся со взрывом при нагревании на МnO2 и O2. Также со взрывом проходит реакция Мn2O7 при соприкосновении с эфиром и спиртом. Хорошо растворяется в воде с образованием марганцевой кислоты НМnO4 - раствора фиолетового цвета:
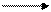 Мn2O7 + Н2O 2НМnO4
Мn2O7 + Н2O 2НМnO4
Марганцевая кислота НМnO4 устойчива только до содержания 20%; безводную получить не удалось. Марганцевую кислоту можно получить при окислении соединений марганца (II) в кислой среде (H2SO4 или HNO3, но не НСl, т.к. НМnO4 в присутствии хлорид-иона Сl- восстанавливается) при помощи сильных окислителей, например РbO2 или NaBiO3:
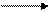 2MnSO4 + 5РbO2 + 6HNO3 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O
2MnSO4 + 5РbO2 + 6HNO3 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O
Марганцевая кислота является сильной кислотой и в водном растворе почти полностью диссоциирована. Концентрированные растворы кислоты неустойчивы и разлагаются с образованием МnO2 и атомарного кислорода:
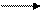 2НМnO4 2МnO2 + Н2O + 3[O]
2НМnO4 2МnO2 + Н2O + 3[O]
или озона:
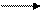 2НМnO4 2МnO2 + O3 + Н2O
2НМnO4 2МnO2 + O3 + Н2O
Соли марганцевой кислоты - перманганаты - устойчивые соединения. Кристаллогидраты их LiMnO4 • 3H2O, NaMnO4 • 3H2O, Mg(MnO4)2 • 5Н2O, Са(МnO4)2 • 5Н2O хорошо растворяются в воде; безводные перманганаты CsMnO4, KMnO4, Ва(МnO4)2 - плохо.
Наибольшее распространение и практическое применение имеет перманганат калия KMnO4, который может быть получен из манганата калия несколькими способами: длительным кипячением в воде:
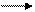 3К2МnO4 + 2Н2O 2КМnO4 + МnO2 + 4KOH
3К2МnO4 + 2Н2O 2КМnO4 + МnO2 + 4KOH
или окисление хлором:
 2К2МnO4 + Cl2 2KMnO4 + 2KCl
2К2МnO4 + Cl2 2KMnO4 + 2KCl
В промышленности КМnO4 получают электролитическим окислением манганата К2МnO4.
Перманганат калия КМnO4 представляет собой устойчивые на воздухе призматические кристаллы фиолетово-красного цвета. При нагревании разлагаются по схеме:
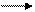 2КМnO4 К2МnO4 + МnO2 + O2
2КМnO4 К2МnO4 + МnO2 + O2
Растворы перманганата калия неустойчивы и разлагаются (особенно на свету) в кислой, щелочной и нейтральной средах по схеме:
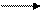 4МnO4- + 4Н+ 3O2 + 4МnO2 + 2Н2O (в кислой)
4МnO4- + 4Н+ 3O2 + 4МnO2 + 2Н2O (в кислой)
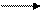 4MnO4- + 2H2O 4MnO2 + 4OH- + 3O2 (в щелочной)
4MnO4- + 2H2O 4MnO2 + 4OH- + 3O2 (в щелочной)
В присутствии сильных восстановителей перманганат-ион МnО-4 в кислой среде превращается в ион Мn2+:
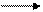 2KMnO4 + 5H2S + 3H2SO4 2MnSO4 + K2SO4 +5S + 8Н2O
2KMnO4 + 5H2S + 3H2SO4 2MnSO4 + K2SO4 +5S + 8Н2O
в щелочной среде ион МnO4-* превращается в ион МnО2-4;
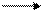 2KMnO4 + KNO2 + 2KOH 2K2MnO4 + KNO3 + Н2O
2KMnO4 + KNO2 + 2KOH 2K2MnO4 + KNO3 + Н2O
в нейтральной среде ион MnO-4 восстанавливается до МnO2:
 2KMnO4 + 6KI + 4Н2O 2MnO2 + 3J2 + 8KOH
2KMnO4 + 6KI + 4Н2O 2MnO2 + 3J2 + 8KOH
Вследствие сильных окислительных свойств КМnO4 применяют для отбелки шерсти, шелка, хлопка, для очистки лабораторной посуды от жиров и других органических веществ (щелочным раствором). Раствором перманганата протравливают древесину, чтобы придать ей вид орехового дерева. Он служит для осветления масла и очистки от примесей сырой уксусной кислоты.
3. Биологическая роль соединений марганца. Их применение в медицине.
Из элементов VII группы побочной подгруппы только марганец является биогенным элементом и одним из десяти металлов жизни, необходимых для нормального протекания процессов в живых организмах. В теле взрослого человека содержится 12 мг (1,6 • 10-5 %). Марганец концентрируется в костях (43%), остальное - в мягких тканях, в том числе и мозге.
В организме марганец образует металлокомплексы с белками, нуклеиновыми кислотами, АТФ, АДФ, отдельными аминокислотами. Содержащие марганец металлоферменты: аргиназа, холигэстераза, фосфоглюкомутаза, пируваткарбоксилаза.
Атомный радиус марганца 128 пм. Это объясняет то обстоятельство, что
марганец может замещать магний, атомный радиус которого 160 пм, в его
соединении с АТФ, существенно влияя на перенос энергии в организме.
Особенно важную роль играет гидролиз аденозинтрифосфата (АТФ) до
аденозиндифосфата (АДФ), который обеспечивает энергетику жизнедеятельности. В организме этот процесс активируется магнием в результате образования комплексов МgАТФ2- и МgАДФ-. Установлено, что ативацию могут осуществлять ионы марганца, причем комплексы МnАТФ2- и МnАДФ- более активны.
Ионы Mg2+ и Мn2+ осуществляют также активацию ферментов - нуклеаз. Эти ферменты катализируют в двенадцатиперстной кишке гидролиз нуклеиновых кислот ДНК и РНК. В результате эти полимеры расщепляются на мономерные единицы - нуклеотиды.
Марганец может входить в состав и неорганических соединений организма. Это, например, малорастворимый марганец магний пирофосфат MnMgP2O7. Кристаллы этой соли локализуются на внутренней поверхности мембраны везикул.
Почти одинаковое значение атомного радиуса марганца и железа, объясняет способность марганца замещать железо в порфидроновом комплексе эритроцита. По той же причине марганец может замещать и цинк в цинкозависимых ферментах, изменяя при этом каталитические свойства.
Калий перманганат КМnO4 - наиболее известное соединение марганца, применяемое в медицине. Используют водные растворы с содержанием КМnО4 от 0,01 до 5%. В качестве крововостанавливающего средства применяют 5% раствор. Растворы калия перманганата обладают антисептическими свойствами, которые определяют его высокой окислительной способностью. Под действием КМnO4 белки окисляют и свертываются (коагулируют). На этом и основано его применение в качестве наружного препарата, обладающего противомикробными и прижигающими свойствами. При этом его действие проявляется только на поверхности кожи и слизистых оболочек.
Окислительные свойства водного раствора KMnO4 используют для обезвреживания токсичных органических веществ. В результате окисления образуются менее токсичные продукты. Например, наркотик морфин превращается в биологически малоактивный оксиморфин.
Высокую окислительную способность перманганата используют в экологии для оценки загрязненности сточных вод (перманганатный метод). По количеству окисленного (обесцвеченного) перманганата определяют содержание органических примесей в воде.
Перманганатный метод (перманганатометрию) используют также в клинических лабораториях для определения содержания мочевой кислоты в крови.
Из других соединений марганец следует отметить марганец (II) сульфат и марганец (II) хлорид, которые используют при лечении малокровия.
Вопросы для самоконтроля:
1. Почему все d-элементы обладают металлическими свойствами?
2. Какой из ионов в ряду МnО-4 – ТеО-4 – ReO-4 является более сильным окислителем и почему?
3. Почему калий перманганат в больших концентрациях является ядом для организма?
4. Какое яркое химическое свойство проявляют перманганаты? Какие продукты восстановления дают перманганаты в зависимости от среды?
5. Перечислите основные ферменты, в состав которых входит марганец? Какую роль в организме выполняют эти ферменты?
6. Напишите уравнений реакции, в которых МnO2 проявляет: а) восстановительные свойства; б) окислительные свойства; в) степень окисления не изменяется.
7. Напишите уравнение реакций с изменением степени окисления марганца в соответствии с приведенной схемой. Укажите характер среды, в которой проходит это превращение:
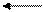
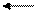
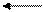
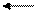
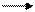
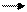
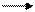
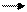 Мn° Мn+2 Mn+4 Мn+6 Мn+7
Мn° Мn+2 Mn+4 Мn+6 Мn+7
8. Какая масса КМnO4 потребуется для окисления:
а) 15,2 г FeSO4 в кислой среде;
б) 12,6 г Na2SO3 в щелочной среде;
в) 16,6 г KJ в нейтральной среде.
Лекция № 31.
Тема: Побочная подгруппа VIII группы.
План
1. Общая характеристика d-элементов VIII группы побочной подгруппы.
2. Распространение железа в природе, получение, физические свойства.
3. Химические свойства железа.
4. Соединения железа. Оксиды. Гидроксиды.
5. Соли железа.
6. Биологическая роль железа.
1. Общая характеристика d-элементов VIII группы побочной подгруппы.
В побочную подгруппу входят три «триады» элементов: первую триаду образуют железо (Fe), кобальт (Со), никель (Ni); вторую - рутений Ru, палладий Pd; третью триаду образуют осмий Os , иридий Yr, платина Pt.
Первую триаду элементов называют семейством железа, т.к. железо, кобальт и никель близки между собой и существенно отличаются от шести остальных. Шесть элементов второй и третьей триад объединяют в семейство платиновых металлов, близких по свойствам.
Атомы металлов семейства железа имеют одинаковое число электронных слов (четыре). На внешнем электронном слое по два электрона (ns2). Они являются d-элементами, т.к. электронами заполняются d-орбитали предпоследнего электронного слоя.
Элементы семейства железа имеют близкие по значениям орбитальные радиусы. Рост электроотрицательности в ряду Fe - Со - Ni показывает, что от железа к никелю должно происходить уменьшение основных и восстановительных свойств. В электрохимическом ряду напряжений элементы подгруппы железа стоят перед водородом. Все эти металлы имеют большую прочность, пластичность, ковкость. Все они ферромагнитные. Железо, кобальт, никель и особенно их сплавы являются важнейшими материалами для современной техники. Особенно важны для организма человека Fe и Со - незаменимые элементы. Их общая характеристика:
¾ Fe - валентные электроны [Ar] 3d64S2; степени окисления +2, +3, +6 (редко);
¾ Со - валентные электроны [Аг] 3d7 4S2, степени окисления +2, +3, +4 (редко).
¾ Ni - валентные электроны [Ar] 3d74S2, степени окисления +2, +3;
¾ Железо образует оксиды: FeO, Fe203, кобальт - Со, Со203 и Co304;
¾ Ni - NiO, Ni203; гидроксиды - Fe(OH)2 и Fe(OH)3; Со(ОН)2 и Co(OH)3; Ni(OH)2 и Ni(OH)3.
Соединения Fe2+ обладают восстановительными свойствами, a Fe3+-окислительными свойствами. Ионы Fe2+ и Fe3+ - активные комплексообразователи с координационным числом = 6. В качестве лигандов выступают органические соединения (белки), CN-, NH3, CO.
Соединения кобальта (II) более устойчивы, соединения кобальта (III) обладают окислительными свойствами. Ионы кобальта выступают в организме в качестве ионов - комплексообразователей с координационным числом 6, причем более устойчивыми являются комплексные соединения кобальта (III). Лигандами чаще всего бывают Н2O, NH3, CN-, NO2-, СO.
2. Распространение железа в природе, получение; физические свойства.
Железо - второй по распространенности в природе металла после алюминия и четвертый по содержанию в земной коре элемент после кислорода, кремния и алюминия. В самородном состоянии встречается очень редко (образует составную часть метеоритов, в небольших количествах иногда вкраплено в базальте). Важнейшими железными рудами являются:
Fe3O4 Магнетит (магнитный железняк) 72% Fe
Fе2OзГематит (красный железняк) 65% Fe
Fe2O3·nH20 Лимонит (бурый железняк) 60% Fe
FeS2 Пирит (серный колчедан) 46,6% Fe
FeCO3 Сидерит (железный шпат) 35% Fe
Химически чистое железо можно получить восстановлением оксида железа (III) водородом или электролизом водных растворов солей железа (II):
Fe2O3 + 3Н2 = 2Fe + 3Н2O
Техническое железо можно получить алюмотермическим восстановлением его оксидов:
3Fe3O4 + 8А1 = 9Fe + 4А12O3
или путем термического разложения пентакарбонила железа:
Fe(CO)5 = Fe + 5CO
Чистое железо имеет ограниченное применение. В современной технике и в обеденной жизни применяются сплавы железа: чугун и сталь. Эти сплавы отличаются разным содержанием углерода (в чугуне - от 1,7% до 5%; в стали - от 0,3% до 1,7%). Для получения чугуна и стали перерабатываются железные руды, содержащие железо в виде оксидов, поэтому в основе химического процесса получения чугуна лежит процесс восстановления железа из этих оксидов углеродом и оксидом углерода (II).
Железо представляет собой серебристо-белый металл с сероватым отливом. Плотность 7,9 г/см3; tпл.= 1539°C; tкип. = 28,72°С. Чистый металл пластичен, однако незначительное количество примеси (главным образом углерода) повышает твердость, хрупкость. Металл ферромагнитен, но при нагревании до определенной температуры ферромагнитные свойства исчезают и металл становится парамагнитным.
3. Химические свойства железа.
В химическом отношении железо довольно активный металл. В реакциях является восстановителем. Однако при обычной температуре железо не взаимодействует даже с самими активными окислителями (галогенами, кислородом, серой). При нагревании железа до белого каления в присутствии кислорода образуется магнетит:
3Fe + 2O2 = Fe3O4 (FeO·Fe2O3)
При нагревании взаимодействует с хлором, серой, азотом, образуя, соответственно хлорид, сульфид, нитрид:
t0
2Fe + 3C12 = 2FeCl3
t0
Fe + S = FeS
t0
2Fe + N2 = FeN
При очень высокой температуре железо реагирует с углеродом, кремнием и
фосфором:
t°
3Fe + С = Fe3C - карбид железа (цементит)
t°
3Fe + Si = Fe3Si - силицид железа
t°
3Fe + 2P= Fe3P2- фосфид железа (II)
Пары воды разлагаются раскаленным железом:
3Fe +4Н2О = Fe3О4 + 4Н2
Во влажном воздухе железо быстро окисляется (корродирует):
4Fe +3O2 + 6Н20 = 4Fe(OH)3
 O
O

 Fe(OH)3 Fe
Fe(OH)3 Fe
О
 О-Н +Н2O
О-Н +Н2O
ржавчина
Железо находится в середине электрохимического ряда напряжений металлов, поэтому является металлом средней активности. Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Разбавленные НСl и H2SO4 растворяют железо:
Fe + 2НСl = FeCl2 + Н2↑
Fe + H2SO4 = FeSO4 + Н2↑
Fe° + 2H+ = Fe2+ + H°2
Концентрированная серная кислота при обычной температуре не взаимодействует с железом, т.к. пассивируется ею. При нагревании реакция идет по уравнению: t0
2Fe + 6H2SO4 (конц.)= Fe2(SO4)3 + 3SO2↑ + 6H2O
Разбавленная азотная кислота (плотность 1,034г/см) на холоду растворяет железо:
4Fe + 10HNO3 = 4Fe(NO3)2 + NH4NO3 + 3H2O
При незначительном увеличении концентрации азотной кислоты (плотность 1,073 г/см3) образуется смесь нитратов железа (II) и железа (III). Под действием концентрированной азотной кислоты при обычных условиях железо становится пассивным из-за образования твердой защитной пленки. При нагревании идет реакция по уравнению:
Fe + 4HNO3 = Fe(NO3)3 + NO↑ + 2H2O.
Из растворов солей железо вытекает металлы, которые расположены правее его в электрохимическом ряду напряжений металлов:
Fe + CuSO4 = FeSO4 + Cu
Fe° + Сu 2+ = Fe2+ + Сu0
4. Соединения железа. Оксиды. Гидроксиды.
Оксид железа II (FeO) получают окислением металлического железа:
2Fe + 02 = 2FeO
или восстановленном оксида железа (III) при t°=500°C:
t°
Fe2O3 + CO = 2FeO + СO2↑ или
Fe3O4 + СО = 3FeO + СO2↑
По физическим свойствам FeO представляет собой черный кристаллический порошок. FeO - основной оксид, легко взаимодействует с кислотами и кислотными оксидами:
FeO + 2HCl = FeCl2 + H2O
FeO + 2Н+ = Fe2+ + Н2O
FeO + SO2 = FeSO3
В азотной кислоте FeO растворяется с образованием нитрата железа (III) и выделением оксида азота (II):
3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5Н2O
Гидроксид железа (II) Fe(OH)2 получается в виде голубовато-белого (до зеленоватого оттенка) осадка при обработке растворов солей железа (II) щелочью без доступа воздуха:
FeSO4 + 2NaOH = Fe(OH)2¯ + Na2SO4
Fe2+ + 2OH- = Fe(OH)2¯
В присутствии воздуха осадок быстро темнеет и становится бурым, т.к. идет окисление до гидроксида железа (III):
4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3¯
Гидроксид железа (II) Fe(OH)2 проявляет свойства основания, легко реагируя с кислотами:
Fe(OH)2 + 2НСl = FeCl2 + 2Н2O
Fe(OH)2 + 2H+ = Fe2+ + 2Н2O
При нагревании разлагается:
t0
Fe(OH)2 = FeO + Н2O
Соединения со степенью окисления железа +2 проявляют восстановительные свойства.
Оксид железа (III) Fe2O3 является устойчивым природным соединением железа, которое встречается в виде минерала красного железняка. Оксид железа (III) можно получить при прокаливании пирита FeS2:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
разложением гидроксида железа (III)
t0
2Fe(OH)3 = Fe2O3 + 3H2O
Fe2O3 - порошок красно-бурого цвета, трудно растворим в воде.
Fe2O3 проявляет амфотерные свойства: легко растворяется в кислотах
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
При сплавлении с гидроксидами или карбонатами щелочных металлов образуют
ферриты (соли железной кислоты):
t0
Fe2O3 + 2NaOH = 2NaFeO2 + Н2O
тв.
t0
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2
тв.
Гидроксид железа (III) Fe(OH)3 образуется при взаимодействии солей железа (III) со щелочами:
FeCl3 + 3NaOH = Fe(OH)3¯ + 3NaCl
Fe3+ + 3ОН- = Fe(OH)3¯
бурый
Гидроксид железа (III) является более слабым основанием, чем Fe(OH)2 и проявляет амфотерные свойства с преобладанием основных. При взаимодействии с разбавленными кислотами легко образуются соответствующие соли:
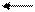
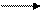 Fe(OH)3 + 3HCl FeCl3 + 3H2O
Fe(OH)3 + 3HCl FeCl3 + 3H2O
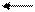
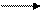 2Fe(OH)3 + 3H2SO4 Fe2(SO4)3 + 6Н2O
2Fe(OH)3 + 3H2SO4 Fe2(SO4)3 + 6Н2O
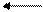
 Fe(OH)3 + 3H+ Fe3+ + 3H2O
Fe(OH)3 + 3H+ Fe3+ + 3H2O
Реакции с концентрированными растворами щелочей протекают при длительном нагревании. Получаются устойчивые гидроксокомплексы с координационным
числом 4 или 6:
t0
Fe(OH)3 + NaOH = Na[Fe(OH)4]
Fe(OH)3 + OH- = [Fe(OH)4]- или
t0
Fe(OH)3 + 3NaOH = Na3[Fe(OH)6]
Fe(OH)3 + 3ОН- = [Fe(OH)6]3-
Соединения со степенью окисления железа +3 проявляют окислительные свойства, т.к. под действием восстановителей Fe3+ восстанавливается до Fe2+:
Fe3++lē = Fe2+
5. Соли железа.
Соли железа (II) являются восстановителями. На воздухе в присутствии воды они постепенно окисляются в соли железа (III):
4FeSO4 + O2 + 2Н2O = 4Fe(OH)SO4
Восстановительные свойства особенно проявляются при действии таких окислителей как перманганат калия:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8Н2O
Практическое значение имеют: железный купорос FeSO4·7H2O - применяется в текстильной промышленности при крашении тканей, в сельском хозяйстве для протравы семян и борьбы с вредителями сельского хозяйства; хлорид железа (II) FeCl2 применяются для получения чистого железа.
Качественной реакцией на ионы железа (II) является комплексная соль K3[Fe(CN)6] - красная кровяная соль (гексацианоферрат (III) калия):
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2¯ + 3K2SO4
3Fe2++ 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2¯ (темно -синий осадок (турнбулева синь))
Соли железа (III) являются окислителями:
2FeCl3 + H2S = 2FeCl2 + 2НС1 + S
2FeCl3 + 2KY= 2FeCl2 + 2KC1 +Y2
Хлорид железа (III) FeCl3 применяется в технике как окислитель в производстве органических красителей, в текстильной промышленности - для протравки тканей при подготовке их к окраске, используются в медицине как кровоостанавливающее средство; сульфат железа (III) Fe2(SO4)3 применяется в технике как химический реактив при гидрометаллургической переработке медных руд, как коагулянт при очистке сточных вод; сульфат аммония железа (III) NH4Fe(SO4)2 • 12Н2O - железоаммонийные квасцы - двойная соль, используемая в текстильной промышленности в качестве протравы.
Ионы железа (III) можно открыть с помощью тиоцианата калия, образуется кроваво-красная окраска:
FeCl3 + 3KNCS = Fe(NCS)3 + 3KC1
Кроваво-красная
окраска
а также при взаимодействии с гексацианоферратом (II) калия (желтая кровяная соль) K4[Fe(CN)6]
Дата добавления: 2016-11-22; просмотров: 776;
