ТОК на аноде на катоде 2 страница
 поглощение
поглощение
энергии
нормальное состояние возбужденное состояние
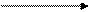
 3s23p33d0
3s23p33d0  3s23p33d1
3s23p33d1
2 неспаренных электрона 4 неспаренных электрона
поглощение энергии
| ↑ | ↑ | |||||||
| ↑ | ↑ | ↑ | 3d2 | |||||
| ↑ | 3p3 | |||||||
| 3s1 |
возбужденное состояние
3s13p33d2
6 неспаренных электрона
В зависимости от состояния электронной оболочки проявляются разные степени окисления (СО). В соединениях с металлами и водородом элементы этой группы проявляют СО = -2. В соединениях с кислородом и неметаллами сера, селен и теллур могут иметь СО = +4 и СО = +6. В некоторых соединениях они проявляют СО = +2.
Кислород уступает по электроотрицательности только фтору. В фтороксиде F2O степень окисления кислорода положительна и равна +2. С остальными элементами кислород проявляет обычно в соединениях степень окисления -2, за исключением водородпероксида Н2O2 и его производных, в которых кислород имеет степень окисления -1. В живых организмах кислород, сера и селен входят в состав биомолекул в степени окисления -2.
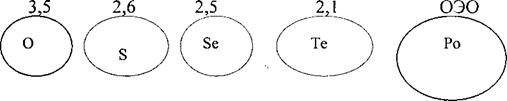
В ряду О - S - Se - Те - Рo увеличиваются радиусы атомов rа и ионов ru. Соответственно в этом же направлении закономерно понижается энергия ионизации Еu и относительная электроотрицательность (ОЭО):






 Увеличение энергии ионизации Еu и ОЭО
Увеличение энергии ионизации Еu и ОЭО
|

|


 Увеличение радиуса атома rа радиуса ru
Увеличение радиуса атома rа радиуса ru
С увеличением порядкового номера электронов VI А группы окислительная активность нейтральных атомов понижается и увеличивается восстановительная активность отрицательных ионов. Все это приводит к ослаблению неметаллических свойств халькогенов при переходе от кислорода к теллуру.
С увеличением порядкового номера халькогенов возрастают характерные координационные числа. Это связано с тем, что при переходе от р-элементов IV периода к р-элементам V и VI периодов в образовании сигма - и пи-связей все большую роль начинают играть d- и даже f- орбитали. Так, если для серы и селена, характерны координационные числа 3 и 4, то для теллура 6 и даже 8.
2. Кислород и его соединения:
а) нахождение в природе, физические свойства получение O2 и O3
Нахождение в природе: кислород самый распространенный элемент. Он составляет 47,2% от массы земной коры; 20,95% по объему или 3,15% по массе воздуха. Входит в состав воды, горных пород, многих минералов, солей и органических веществ. Кислород составляет 50 - 85 % массы тканей растений и животных. В свободном состоянии существует в виде двух аллотропных модификаций: O2 - кислород и О3 - озон.
Кислород O2 при обычных условиях - газ без цвета и запаха; Ткип. = - 183° С, немного тяжелее воздуха, плотность 1,43. В воде малорастворим: в 1 л ее при н.у. растворяется ≈ 0,07 г O2. Жидкий кислород - подвижная, слегка голубоватая жидкость. О3 при обычных условиях - газ синего цвета, с резким запахом;
Tкип= -1120С. Растворимость в воде выше, чем у кислорода. Жидкий озон - вещество темно-синего, почти черного цвета. Взрывоопасен во всех агрегатных состояниях, т.к. самопроизвольно разлагается с выделением большого количества энергии: 2O3 = 3О2 + Q. В природе озон находится в верхних слоях атмосферы, образует тонкий «озоновый» слой, защищающий Землю от губительного ультрафиолетового излучения Солнца.
В природе кислород образуется в процессе фотосинтеза в зеленых листьях растений:
hv
 6СO2 + 6Н2O С 6 Н 12 O 6 + 6 O2
6СO2 + 6Н2O С 6 Н 12 O 6 + 6 O2
хлорофилл
Промышленное получение путем фракционной перегонки воздуха: перевод воздуха в жидкое состояние при низких температурах и высоком давлении; далее испарение жидкого воздуха (первым отгоняется из смеси азот, имеющий более низкую Ткип.). В остающейся после этого жидкой фракции содержится почти чистый кислород.
Чистый кислород получают путем электролиза воды в присутствии электролита - щелочи:
2Н2O = 2Н2↑+ O2↑
Получение в лаборатории путем разложения при нагревании неустойчивых соединений; содержащих в своем составе кислород:
t, МnO2
2КС1O3 ==== 2КС1 + 3O2↑
t
2КМnO4 = К2МnO4 + МnO2 + O2↑
t
2NaNO3 = 2NaNO2 + O2↑
t
2Н2O2 = 2Н2O + O2↑
 Озон O3 образуется в верхних слоях атмосферы (высота около 50 км) из свободного кислорода. Под влиянием УФЛ молекулы O2 диссоциируют с образованием атомарного кислорода: O2 + hv →О + О; атомы кислорода при столкновении с его молекулами образуют озон: O2 + О O3. В небольших количествах озон образуется в нижних слоях атмосферы во время грозовых разрядов. В промышленности О3 получают в озонаторах, в которых через воздух или чистый кислород пропускают электрический ток, который инициирует образование атомарного кислорода. Выход озона не превышает 10% .
Озон O3 образуется в верхних слоях атмосферы (высота около 50 км) из свободного кислорода. Под влиянием УФЛ молекулы O2 диссоциируют с образованием атомарного кислорода: O2 + hv →О + О; атомы кислорода при столкновении с его молекулами образуют озон: O2 + О O3. В небольших количествах озон образуется в нижних слоях атмосферы во время грозовых разрядов. В промышленности О3 получают в озонаторах, в которых через воздух или чистый кислород пропускают электрический ток, который инициирует образование атомарного кислорода. Выход озона не превышает 10% .
б) химические свойства свободного кислорода.
Кислород обладает высокой окислительной способностью (О02 + 4ē →2O-2). O2 взаимодействует со всеми химическими элементами, исключая инертные газы; со всеми простыми веществами кроме галогенов, золота и платиновых металлов. При взаимодействии кислорода с металлами и неметаллами образуются оксиды:
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO
3000
2Cu + O2 = 2CuO
4P + 5O2 = 2P2O5
2500
S + O2 = SO2
7000
С+ O2=СO2
Исключение: при окислении кислородом натрия и калия образуются пероксиды:
2Na + O2 = Na2O2 (Na - О - О - Na)
Почти все реакции с участием кислорода экзотермичны, за редким
исключением:
о
1200
 N2 + O2 2NO - Q
N2 + O2 2NO - Q
Характерной особенностью многих реакций соединения с кислородом является выделение теплоты и света, т.е. реакции горения.
Взаимодействие кислорода со сложными веществами с водородными соединениями неметаллов образуется вода, а неметалл выделятся либо в свободном состоянии, либо в виде своего оксида:
4HJ + O2 = 2Y2 + 2Н2O
2H2S + O2 = 2S + 2Н2O
или
2H2S + O2 = 2SO2 + 2Н2O
4NH3 + 3O2 = 2N2 + 6H2O
или
t, кат.
4NH3 + 5O2 = 4NO + 6Н2O
t
СН4 + O2 = С + 2Н2O
или
СН4 + 2O2 = СO2 + 2Н2O
Под действием кислорода низшие оксиды и гидроксиды переходят в соответствующие соединения с более высокой степенью окисления:
+2 +4
2NO + O2 = 2NO2
+4 t +6
2SO2 + O2 = 2SO3
+3 +5
Р2O3 + O2 = Р2O5
+2 +4
2СО + O2 = 2СO2
+2 +3
4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3
В кислороде сгорают практически все органические вещества:
 С2Н5ОН + 3O2 2СO2 + 3Н2O
С2Н5ОН + 3O2 2СO2 + 3Н2O
Более сильным окислителем является озон, т.к. при размножении его идет образование атомарного кислорода. O3 может непосредственно взаимодействовать даже с галогенами, окисляя их до высших оксидов. Бумага, смоченная растворами КJ и крахмала, синеет, если в воздухе содержится озон (крахмал с йодом образует окрашенное в синий цвет соединение). Качественно и количественно озон определяют с помощью реакции:
O3 + 2KJ + Н2O = J2↓ + 2КОН + O2↑
Озон обладает бактерицидным действием (обеззараживание воды и дезинфекция воздуха).
Кислород необходим для дыхания; окисление кислородом углеводов, жиров и белков служит источником энергии для живых организмов. Важное значение и другой процесс, в котором участвует кислородслепление и гниение погибших животных и растений; при этом сложные органические вещества превращаются в более простые, которые вступают в общий круговорот.
в) соединения кислорода с водородом.
Н2O - вода самое распространенное на Земле вещество. Поверхность земной коры на 3/4 покрыта водой. В больших количествах вода находится в атмосфере и земной коре. Общие запасы свободной воды на Земле составляют 1,4 млрд. км3. Почти столько же воды находится в физически и химически связанном состоянии в природных кристаллогидратах.
Организмы животных и растений содержат от 50 до 90% воды. В организме человека она составляет около 65% от массы тела. Большая часть воды в организме находится внутри клеток (70%), около 23% составляет межклеточная вода, остальная (7%) находится внутри кровеносных сосудов и в составе плазмы крови.
Вода, взятая из любого природного источника, всегда содержит много примесей (дождевая вода наиболее чистая из природных вод, содержит в сред природного источника, всегда содержит много примесей (дождевая вода наиболее чистая из природных вод, содержит в среднем 35 мг/л сухого остатка). При обычных условиях вода - прозрачная бесцветная жидкость. При охлаждении до 00С переходит в твердое состояние лед, при этом происходит резкое увеличение объема воды (лед легче воды и может плавать). При t°= 1000C и атмосферном давлении вода кипит и переходит в пар. Чистая вода почти не проводит электрический ток. Она имеет наибольшую из всех жидкостей и твердых веществ удельную теплоемкость (количество теплоты в кДж, которое нужно для нагревания 1г вещества на 10С).
Вода - одно из наиболее реакционноспособных веществ. В молекуле воды и водород, и кислород находятся в устойчивых степенях окисления, соответственно + 1 и - 2. Следовательно, вода не обладает ярко выраженными окислительно-восстановительными свойствами. Окислительно-восстановительные свойства возможны только при взаимодействии воды только с очень активными восстановителями или очень активными окислителями:
+ 1 О
2Na + 2Н2O = 2NaOH + Н2↑ (вода - окислитель)
Са + 2Н2O = Са(ОН)2 + Н2↑
При нагревании возможно взаимодействие воды или водного пара с менее активными металлами:
+1 t о
Mg + 2Н2O = Mg(OH)2 + Н2↑
+ 1 О
3Fe + 4Н2O = Fe3O4 + 4Н2↑
В роли окислителя вода выступает также при взаимодействии с гидридами щелочных и щелочноземельных металлов, являющихся очень сильными восстановителями:
-1 +1 О
NaH + Н2O = NaOH + Н2↑
При взаимодействии с таким сильным окислителем как фтор, вода выступает в роли восстановителя:
-2 О
2F2 + 2Н2O = 4HF + O2
При температуре выше 1000° С водяной пар разлагается на водород и кислород, т.е. происходит внутримолекулярный окислительно-восстановительный процесс:
+ 1 -2 0 0
2Н2O = 2Н2↑ + O2↑
Для жидкой воды характерна самоионизация. Молекулы ее взаимно влияют друг на друга. Тепловое движение частиц вызывает ослабление и гетеролитический разрыв связей О - Н в отдельных молекулах воды. При этом протон присоединяется к атому кислорода соседней молекулы воды по донорно-акцепторному механизму:




 :O – H + :O – H H O – H + + :O: -
:O – H + :O – H H O – H + + :O: -



H H H H
 H2O + H2O H3O+ + OH- гидроксид ион
H2O + H2O H3O+ + OH- гидроксид ион
Ион
гидроксония
Ион гидроксония является гидратированным ионном водорода H+ · H2O, поэтому процесс ионизации воды выражаются следующим уравнением:

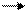 H2O H+ + OH-. Таким образом, при ионизации одновременно образуются ионы H+ и OH2, т.е. вода является амфотерным электролитом. Но степень ионизации воды незначительна. Концентрация ионов H+ и OH- в воде равны 10-7 моль/л, поэтому вода не проявляет сколько-нибудь выраженных кислот или основных свойств.
H2O H+ + OH-. Таким образом, при ионизации одновременно образуются ионы H+ и OH2, т.е. вода является амфотерным электролитом. Но степень ионизации воды незначительна. Концентрация ионов H+ и OH- в воде равны 10-7 моль/л, поэтому вода не проявляет сколько-нибудь выраженных кислот или основных свойств.
Вода оказывает сильное ионизирующее действие на растворенные в ней электролиты. Под действием диполей воды полярные ковалентные связи в молекулах растворенных веществ превращаются в ионные, в результате чего растворы многих веществ в воде проявляют кислотные свойства:
H2O
HCl === H+ + Cl-
хлороводород

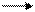 CH3COOH CH3COO- + H2O
CH3COOH CH3COO- + H2O
уксусная кислота
Присоединением протона водорода молекулы воды к молекулам некоторых растворенных веществ обусловлены основные свойства водных растворов веществ:
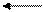
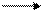 NH3 + H+ ʄ OH- NH4+ + OH-
NH3 + H+ ʄ OH- NH4+ + OH-
аммиак
CH3 – NH2 + H+ ʄ OH- → [CH3 – NH3]+ + OH-
метиламин
Полярность и малые размеры молекул воды определяют ее сильные гидратирующие свойства. Гидратация - это присоединение воды к веществу:
— Гидратация ионов: при растворении в воде электролитов образующиеся при диссоциации ионы присоединяют определенное число молекул воды. Прочность связей между ионов и молекулами воды зависит от природы иона, его заряда, размера, строения электронной оболочки, от концентрации и температуры раствора. Гидратированные ионы могут существовать не только в растворе, но и в твердом состоянии: кристаллогидраты CuSO4 • 5Н2O - медный купорос; FeSO4 • 7Н2O -железный купорос; CaSO4 • 2Н2O - гипс; аквакомплексы [Сr(Н2O)6]С13, [Pt(H2O)4]CI4.
— Гидратация оксидов: при гидратации кислотных оксидов образуются кислоты SO3 + Н2O = H2SO4; при гидратации основных оксидов образуется основания ВаО + Н2O = Ва(ОН)2.
Реакция гидролиза:
— 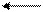
 Гидролиз солей NH4C1 + Н2O NH4OH + НС1 (NH+4 + Н2O = NH4OH + Н+)
Гидролиз солей NH4C1 + Н2O NH4OH + НС1 (NH+4 + Н2O = NH4OH + Н+)
— Гидролиз карбидов углеводородов: А14С3 + 12Н2O →4А1(ОН)3↓+ 3СН4↑
Вода в небольших количествах является катализатором:
Н2O
2А1 + 3 J2→ 2A1J3
Пероксид водорода - Н2O2 (бесцветная жидкость, Тпл. = -0,41°С ; Ткип. =150,2° С; плотность 1,45г/см3). В чистом виде взрывоопасен. В продажу поступает 30%-ный водный раствор, называемый пергидролем, или 3% -ный раствор.
 Раствор пероксида водорода имеет, кислую реакцию (диссоциация по типу слабой кислоты): Н2O2 Н+ + НO2- (рН ≈6). Пероксиды металлов (Na2O2, BaO2) -это соли слабой кислоты пероксида водорода, следовательно, Н2O2 можно получить действием на пероксид металла более сильной кислотой:
Раствор пероксида водорода имеет, кислую реакцию (диссоциация по типу слабой кислоты): Н2O2 Н+ + НO2- (рН ≈6). Пероксиды металлов (Na2O2, BaO2) -это соли слабой кислоты пероксида водорода, следовательно, Н2O2 можно получить действием на пероксид металла более сильной кислотой:
ВаO2 + H2SO4 = BaSO4 + H2O2
Пероксиды металлов характеризуются наличием в молекулах перекисной цепочки из атомов кислорода:
О


 ВаNa – O
ВаNa – O

О Na – O
H2O2 проявляет окислительно-восстановительную двойственность:
— Сильный окислитель: 2HJ + Н2О2 = J2 + 2H2O
— Реакции диспропорционирования:
2ē

 Н2O2 + Н2O2→2Н2O + O2↑
Н2O2 + Н2O2→2Н2O + O2↑
Химические свойства пероксидов:
— Гидролиз ВаO2 + 2Н2O = Ва(ОН)2 + Н2O2 (сильнощелочная реакция)
— Взаимодействие с кислотами (далее с угольной)
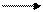 Na2O2 + H2SO4 Na2SO4 + H2O2
Na2O2 + H2SO4 Na2SO4 + H2O2
-— Взаимодействие Na2O2 с двуокисью углерода
2Na2O2 + 2СO2 = 2Na2CO3 + O2↑ (источник кислорода на подводных лодках)
Раствор Н2O2 (2,7 - 3,3%) является фармокопейным препаратом, применяется как бактерицидное и кровоостанавливающее средство. Бактерицидное действие объясняется разложением Н2O2 в тканях под действием фермента каталазы с освобождением молекулярного кислорода, окисляющего белки протоплазмы микроорганизмов, что приводит к гибели микроорганизмов.
Кровоостанавливающее действие Н2O2 объясняется обильным образованием пузырьков кислорода, на поверхности которых ускоряется процесс перехода фибриногена в фибрин. Образующаяся при разложении Н2O2 пена уносит с поверхности кожи и из раневых полостей частички инородных тел, сгустки крови, гноя, способствуя механическому очищению ран.
3. Сера, Аллотропные видоизменения, химические свойства.
Сера имеет степень окисления -2, 0, +4, +6. В природе встречается как в свободном состоянии (самородная сера), так и в виде различных соединениях. Сера также содержится в небольших количествах в организмах растений и животных. Общее содержание серы в земной коре составляет около 0,1%.
В виде простого вещества сера имеет большее число аллотропных модификаций, различающихся между собой составом и строением молекул. Число атомов в молекулах различных аллотропов серы изменяется в широком диапозоне -от 3 до 20; молекулы могут иметь циклическое и линейное строение. Наиболее устойчивы 3 модификации серы: ромбическая (α) - S8; моноклинная (β) - S8 и пластическая (полимерная).
В обычных условиях сера существует в виде ромбической модификации. Ее молекулы содержат по 8 атомов серы, соединенных одинарными ковалентными связями в замкнутый цикл:

 S-S-S
S-S-S

 S S
S S
S-S-S
Ромбическая сера - твердое кристаллическое вещество желтого цвета, практически нерастворимое в воде, но хорошо растворимое в сероуглероде CS2 и ацетоне Ткип =+112°С.
При температуре выше 950 С ромбическая сера превращается в моноклинную модификацию. Расплавы серы содержат почти все ее аллотропы.
В лабораторных условиях свободную серу можно получить из ее соединений с помощью окислительно-восстановительных реакций:
+4 -2 0
SO2 + Н2O + 2H2S = 3S + ЗН2O
-2 0
2H2S + O2 = 2Н2O + 2S
Сера - химически активный неметалл. При взаимодействии с простыми веществами, образованными элементами с меньшей ЭО, сера проявляет окислительные свойства:
 t
t
S + 2Na = Na2S t
S + Mg = MgS
t
3S + 2A1 = A12S3
0 -2
S + 2ē →S
сульфиды металлов
t

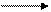 S + H2 H2S сероводород
S + H2 H2S сероводород
t

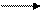 2S + C CS2 сероуглевод
2S + C CS2 сероуглевод
t
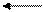
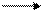 3S + 2P P2S3 сульфид фосфора (III)
3S + 2P P2S3 сульфид фосфора (III)
При взаимодействии с простыми веществами, образованными элементами с большей ЭО, сера проявляет восстановительные свойства:
-2ē

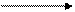 S+2
S+2
-4ē
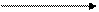 S0 S+4
S0 S+4
-6ē
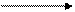 S+6
S+6
Сера горит на воздухе голубоватым пламенем, при этом образует диоксид
серы: t +4
S + O2 = SO2
Фтор воспламеняет серу при обычной температуре с образованием
гексафторида серы: t +6
S + 3F2 = SF6
Хром и бром реагирует с серой при небольшом нагревании с образованием
галогенидов: +2
S + C12 = SC12
Сера может быть окислена также некоторыми сложными веществами:
+4
S0 + 2H2SO4(kohц.) = 3SO2↑ + 2Н2O
S0 + 6HNO3(kohц.) = H2SO4 + 6NO2↑ + 2H2O
В водных растворах щелочей при нагревании сера подвергается самоокислению -самовосстановлению (диспропорционированию):
3S0 + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Биологическая роль р-элементов VI А группы. Применение их соединений в медицине.
Кислород - органоген. Роль в процессах жизнедеятельности; большинство окислительно-восстановительных реакций в организме протекает при участии кислорода и его активных форм. Фагоцитарные функции организма также связаны с наличием кислорода, уменьшение содержания кислорода в организме понижает его защитные свойства.
В медицинской практике кислород применяют для вдыхания при кислородной недостаточности (гипоксии), заболеваниях дыхательных путей, сердечнососудистой системы, отравлениях оксидом углерода (II), сильной кислотой (HCN). Широко используется в клинической практике гипербарическая оксигенация -применение кислорода под повышенным давлением; значительно улучшается кислородное насыщение тканей, гемодинамика, защищается головной мозг от гипоксии.
Дата добавления: 2016-11-22; просмотров: 746;
