Основные положения теории окисления – восстановления
Сущность окисления состоит в отдаче окисляющимся веществом (восстановителем) валентных электронов окислителю, который, принимая электроны, восстанавливается.
Сущность восстановления состоит в присоединении восстанавливающимся веществом (окислителем) электронов восстановителя, который, отдавая электроны, окисляется.
Например, в реакции:
С + PbO = Pb + CO
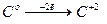 – окисление; восстановитель
– окисление; восстановитель
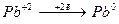 – восстановление; окислитель
– восстановление; окислитель
Процесс отдачи веществам (атомом, ионом) электронов называется окислением, а процесс присоединения веществом электронов называется восстановлением.
Вещества (атомы, ионы) в процессе химической реакции, присоединяющие электроны, называются окислителями, а вещества, отдающие электроны, называются восстановителями.
3. Основные восстановители. Основные окислители.
Группа восстановителей: восстановителями могут быть нейтральные атомы металлов – восстановительные свойства металлов зависят от агрегатного состояния, среды, величины радиуса атома и количества валентных элементов. Сильными восстановителями являются атомы с малым потенциалом ионизации. К ним относятся атомы электронов двух первых главных подгрупп периодической системы элементов – щелочные и щелочноземельные металлы, а также алюминий, железо и другие. Франций является самым сильным восстановителем из всех элементов периодической системы. В химических реакциях восстановители отдают электроны согласно схеме: 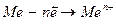 .
.
Восстановительные свойства проявляют и неметаллы (углерод, водород); отрицательно заряженные ионы неметаллов (к данной группе относятся анионы в бескислородных кислотах и их солях: H2S-S2-, H2Se-Se2-, HJ-J-, HBr-Br- и другие. Сильные восстановительные свойства проявляют водород, находящийся в степени окисления (-1), т.е. в гидридах металлов – CaH2); положительно заряженные ионы металлов в низшей степени окисления (это ионы металлов, которые при взаимодействии с сильными окислителями могут еще повышать свою степень окисления: Sn+2, Fe+2, Cr+2, Mn+2); сложные ионы и молекулы, содержащие атомы в состоянии промежуточной степени окисления (сложные ионы SO 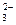 , NO
, NO 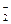 , AsO
, AsO 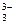 , CrO
, CrO 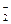 , [Fe (CN)6]4- проявляют восстановительные свойства, так как у них атомы серы, азота, мышьяка, хрома и железа находятся в состоянии промежуточной степени окисления: S+4, N+3, As+3, Cr+3, Fe+2; аналогичными свойствами обладают и некоторые молекулы:
, [Fe (CN)6]4- проявляют восстановительные свойства, так как у них атомы серы, азота, мышьяка, хрома и железа находятся в состоянии промежуточной степени окисления: S+4, N+3, As+3, Cr+3, Fe+2; аналогичными свойствами обладают и некоторые молекулы: 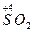 ,
, 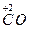 ,
, 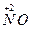 ).
).
Окислителями могут быть: нейтральные атомы и молекулы (сильными окислителями являются неметаллы – фтор, кислород, хлор); положительно заряженные ионы металлов (сильные окислители – положительно заряженные ионы с высокой степенью окисления: Fe3+, Cu2+, Sn4+); сложные ионы и молекулы, содержащие атомы металла в состоянии высшей степени окисления ( 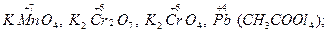 сложные ионы и молекулы, содержащие атомы неметалла в состоянии высшей положительной степени окисления (к числу этих окислителей относятся кислородные кислоты, их ангидриды и соли:
сложные ионы и молекулы, содержащие атомы неметалла в состоянии высшей положительной степени окисления (к числу этих окислителей относятся кислородные кислоты, их ангидриды и соли: 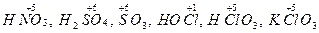 ).
).
Кислород (O2) – применяется для интенсификации производственных процессов в металлургической и химической промышленности; используется в смеси с ацетиленом для получения высоких температур (3500°С) при сварке и резке металлов; широко применяется в медицине, вдыхание 40-60% смеси кислорода с воздухом ускоряет процессы окисления в организме, уменьшая нагрузку на сердце и легкие. Кислород является сильным окислителем, особенно при нагревании. Атомарный кислород значительно активнее молекулярного. Восстановительные свойства кислород проявляет лишь по отношению к фтору.
2NaOH + 2F2 = OF2 + 2NaF + H2O
Озон (O3) – более сильный окислитель, чем кислород. Он обесцвечивает многие красящие вещества, окисляет металлы (за исключением золота, платины), аммиак в азотистую и азотную кислоты, сульфиды в сульфаты. Озон убивает бактерии, поэтому применяется для обеззараживания воды и для дезинфекции воздуха. Озон легко разлагается с выделением атомарного кислорода.
O3 = O2 + O
Озон легко окисляет серебро.
Ag + O3 = AgO + O2
Перманганат калия (KMnO4) – очень сильный окислитель, применяется для окисления многих органических соединений. Окисляет сульфиты в сульфаты, нитриты в нитраты, йодистый калий до свободного йода, соляную кислоту до хлора, перекись водорода до кислорода. Характер восстановления KMnO4 зависит от среды, в которой протекает реакция:
в кислой среде (рН < 7)
KMnO4 ↔ K+ + MnO 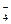
MnO 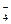 → Mn2+
→ Mn2+
фиолетово- слабо-розовая
малиновая или бесцветная
окраска окраска
в нейтральной или слабощелочной среде (рН ≥ 7)
MnO 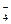 → MnО2↓
→ MnО2↓
фиолетово- бурый
малиновая
окраска
в сильнощелочной среде (рН >> 7)
MnO 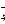 → MnO
→ MnO 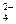
фиолетово- зеленая
малиновая окраска
окраска
Хромовая и двухромовая кислоты – используются соли этих кислот: хромат калия K2CrO4 и бихромат калия K2Cr2O7
CrO 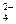 ; Cr2О
; Cr2О 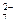
желтая оранжевая
окраска окраска
Азотная кислота (HNO3) – сильнейший окислитель. Азот в составе аниона NO 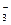 может в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) принимать от 1 до 8 электронов:
может в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) принимать от 1 до 8 электронов:
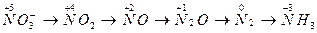
При восстановлении азотной кислоты практически не выделяется газообразный водород.
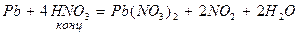
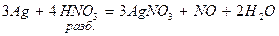
4 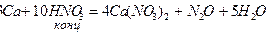
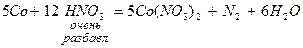
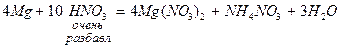
Большинство неметаллов восстанавливают азотную кислоту до оксида азота (II).
Дата добавления: 2016-11-22; просмотров: 932;
