Г) Степень диссоциации (ионизации).
Для каждого электролита степень электролитической диссоциации определяют опытным путем, измеряя электропроводность его водного раствора. Степень диссоциации (a) выражается в процентах или в долях единицы.
Степень электролитической диссоциации равна отношению числа молекул, которые распались на ионы, к общему числу растворенных молекул электролита.
a = n .100% или a = n , где n – число молекул, распавшихся и на ионы;
N N
N – общее число растворенных молекул.
Пример: aCH3OOH в 0,1 M растворе равна 1,36 %, что означает: из 10000 молекул CH3OOH 136 распадаются на ионы по уравнению реакции:
 CH3COOH CH3COO- + H +
CH3COOH CH3COO- + H +
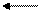
Степень диссоциации зависит от природы растворителя и природы растворенного вещества.
Одно и то же вещество в одних растворителях может вести себя как электролит, в других – как неэлектролит (молекулы серной кислоты хорошо диссоциируют в воде, слабее в этаноле и совсем не диссоциируют в бензоле).
Объяснение в том, что вода является одним из наиболее полярных растворителей, этанол – слабополярный, а бензол – неполярный растворитель.
Вода является основным растворителем, следовательно, рассматриваем классификацию электролитов по степени диссоциации в водных растворах.
На степень ионизации влияет тип химической связи в молекулах электролита, так как в этом случае диссоциация проходит в разной степени. Для электролитов с ионными или сильно полярными ковалентными связями диссоциация в воде протекает практически нацело. Это сильные электролиты и степень диссоциации равна 1 (100%). К ним относятся:
- практически все соли;
- кислоты: HClO4 (хлорная), HClO3 (хлорноватая), HCl (хлороводородная), HBr (бромоводородная), HJ (йодоводородная), HNO3 (азотная), H2SO4 (серная), H2Cr2O7 (двухромовая), H2CrO4 (хромовая). Это сильные кислоты.
- щелочи LiOH, NaOH, KOH, CsOH, RвOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 - это сильные основания.
Электролиты со слабо полярными связями диссоциируют в воде частично. Электролиты, диссоциирующие не полностью являются слабыми и степень диссоциации их меньше 1(100%).
К ним относятся:
- слабые кислоты: HClO2 (хлористая), HClO(хлорноватистая), HNO2(азотистая), H2CO3 (угольная), H2SiO3 (кремниевая), H3PO4 (ортофосфорная), HF (фтороводородная), H3BO3 (борная), CH3 COOH (уксусная), H2S (сероводородная), HCN (цианидводородная).
- слабые малорастворимые в воде основания и амфотерные гидроксиды: Fe(OH)2 , Fe (OH)3 , Cu(OH)2 , Pb(OH)2 , Al (OH)3 , Cr(OH)3
- вода H2O
- NH4OH
На степень диссоциации слабых электролитов влияет несколько факторов.
Степень ионизации электролита зависит от его концентрации в растворе. Разбавление раствора ведет к повышению степени диссоциации электролита, так как с уменьшением его концентрации уменьшается вероятность встречи ионов в растворе.
Повышение концентрации электролита в растворе понижает степень его ионизации.
Изменение температуры раствора электролита так же влияет на степень ионизации. При повышении температуры степень диссоциации электролита увеличивается, так как с повышением температуры энергия молекул увеличивается, химическая связь в них ослабляется, что облегчает процесс диссоциации электролитов; понижение температуры дает противоположный эффект.
На степень диссоциации влияет действие одноименного иона. Например, при диссоциации уксусной кислоты устанавливается равновесие:
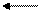
 CH3COOH CH3COO- + H+
CH3COOH CH3COO- + H+
Согласно принципу Ле-Шателье, изменяя концентрацию одного из образующихся веществ, происходит смещение равновесия. В данном случае при добавлении в раствор ацетата натрия (CH3COONa), который является сильным, электролитом, увеличивается количество ацетат-ионов (CH3COO-) и равновесие смещается влево, то есть в сторону образования недиссоциированных молекул и степень диссоциации уксусной кислоты уменьшается. Следовательно, уменьшится концентрация ионов водорода и кислотность среды понизится.
Подобным образом можно понизить степень диссоциации раствора аммиака. При добавлении аммонийной соли (например, хлорид аммония NH4Cl) резко повысится концентрация ионов аммония и равновесия сместится влево.
 NH4OH NH4+ + OH-
NH4OH NH4+ + OH-
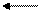
Заметно понизится концентрация гидроксид-ионов (OH-), т.е. уменьшится щелочность раствора.
Таким образом, чтобы понизить степень диссоциации слабого электролита, необходимо добавить в раствор другой сильный электролит с одноименным ионом.
д) Константа диссоциации (ионизации)
Слабые электролиты в водных растворах диссоциируют только частично, поэтому в растворе устанавливается динамическое равновесие между молекулами и ионами.
Ионное равновесие раствора уксусной кислоты выражается уравнением:
+ H2O
 CH3COOH CH3COO- + H+
CH3COOH CH3COO- + H+

Применив закон действующих масс, можно написать выражения для константы равновесия:
Kравн. = [CH3COO- ] . [H+]
[CH3COOH ]
Константа равновесия диссоциации для слабых электролитов называется константой диссоциации.
В применении к диссоциации любого слабого электролита.
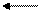
 АnBm nA+ + mB-
АnBm nA+ + mB-
К дисс. определяется выражением:
К дисс. = [A] n . [B]m , где
[An Bm ]
[A+] – концентрация катиона; [B-] – концентрация аниона; [An Bm] - концентрация недиссоциированных молекул.
K дисс. для слабых электролитов не зависит от концентрации раствора и при постоянной температуре является постоянной величиной для данного электролита. Чем выше К дисс,. тем больше степень диссоциации для данного электролита, тем сильнее этот электролит.
Многоосновные кислоты и основания многовалентных металлов диссоциируют ступенчатого, и каждая стадия диссоциации характеризуется собственной константой диссоциации.
Диссоциация фосфорной кислоты:
I ступень
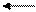
 H3PO4 H+ + H2PO4 – K дисс.1 = 7,6 . 10-3
H3PO4 H+ + H2PO4 – K дисс.1 = 7,6 . 10-3
II ступень
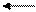
 H2PO4 - H+ + HPO4 2– K дисс.2 = 6,2 . 10-6
H2PO4 - H+ + HPO4 2– K дисс.2 = 6,2 . 10-6
III ступень
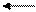
 HPO4 2- H+ + PO4 3– K дисс.3 = 4,4 . 10-13
HPO4 2- H+ + PO4 3– K дисс.3 = 4,4 . 10-13
Значение K дисс. для каждой последующей ступени уменьшается.
При диссоциации оснований многовалентных металлов наблюдается подобное явление.
Дата добавления: 2016-11-22; просмотров: 2741;
