Вопрос № 2. Количественные характеристики процесса диссоциации (20 мин).
Диссоциация кислот, гидроксидов, солей
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Основность кислотыопределяется числом катионов водорода, образующихся при диссоциации.
HCl ⇄ H+ + Cl- (одноосновная кислота)
H2SO4 ⇄ 2H+ + (SO4)2- (двухосновная кислота)
Двух- и многоосновные кислоты диссоциируют ступенчато, причем диссоциация чаще всего идет по первой , реже второй ступени.
Н3РО4 ⇄ Н+ + Н2РО4- ( I ступень)
Н2РО4- ⇄ Н+ + НРО42- ( II ступень)
НРО42- ⇄ Н+ + РО43- ( III ступень)
Гидроксидами или основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Кислотность оснований определяется числом гидроксид ионов, образующихся при диссоциации.
NH4OH ⇄ NH4+ + OH- (однокислотный гидроксид)
Са(ОН)2 ⇄ Са2+ + 2ОН- (двухкислотный гидроксид)
Аналогично кислотам двух- и многокислотные гидроксиды диссоциируют ступенчато:
Са(ОН)2 ⇄ СаОН+ + ОН- ( I ступень)
СаОН+ ⇄ Са2+ + ОН- (II ступень)
Имеются электролиты, которые при диссоциации одновременно образуют и катионы водорода и гидроксид-ионы. Такие электролиты называются амфотерными. Например,
Zn(OH)2 ⇄ Zn2+ + 2OH-
Zn(OH)2 = H2ZnO2 ⇄ ZnO22- + 2H+
Амфотерным электролитом является вода, т.к . в незначительном количестве диссоциирует Н2О = НОН ⇄ Н+ + ОН-.
Однако такая запись является упрощенной, поскольку в растворе катион водорода существует в виде гидратированной частицы – иона гидроксония Н+(Н2О) = Н3О+. Для простоты в реакциях ион гидроксония условно обозначают Н+.
Солями называются электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4+) и анионы кислотных остатков.
Na2SO4 ⇄ 2Na+ + SO42-
Так диссоциируют средние соли. Кислые и основные соли диссоциируют ступенчато:
KHSO4 ⇄ K+ + HSO4- (I ступень)
HSO4- ⇄ H+ + SO42- (II ступень)
MgOHCl ⇄ MgOH+ + Cl- (I ступень)
MgOH+ ⇄ Mg2+ + OH- (II ступень)
(Все определения, формулы, графики даются под запись).
Вопрос № 2. Количественные характеристики процесса диссоциации (20 мин).
Поскольку электролитическая диссоциация – процесс обратимый, то в растворе наряду с ионами присутствуют и молекулы. Количественно охарактеризовать процесс диссоциации можно с помощью двух основных величин: степени диссоциации и константы диссоциации, связанных между собой.
Степень диссоциации ( a)– это отношение числа распавшихся на ионы молекул(n) к общему числу молекул (N): a = n/N.
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах.
При a = 0 диссоциация отсутствует; при a = 1 (100 %) – электролит полностью распадается на ионы; a = 0,2 (20 %) означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от:
1) природы электролита и растворителя;
2) концентрации растворенного вещества;
3) температуры – степень диссоциации возрастает при нагревании раствора.
Количественно оценить процесс диссоциации можно и с помощью константы диссоциации электролита.
Запишем уравнение диссоциации слабой цианистоводородной кислоты
HCN ⇄ H+ + CN- .
В момент установившегося равновесия в растворе скорость диссоциации молекул на ионы будет равна скорости образования молекул из ионов. Константа равновесия данного процесса и будет константой диссоциации электролита:
Кдис. HCN = 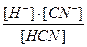
Из приведенного выражения видно, что чем больше значение Кдис., тем больше концентрация образовавшихся ионов Н+ и CN-, и, следовательно, больше способность к диссоциации.
Константа и степень диссоциации связаны между собой. Для приведенного примера обозначим: с – исходная концентрация НСN, моль/л; a - степень диссоциации НСN. Тогда в состоянии равновесия концентрации ионов и молекул будут
[H+] = a× c; [CN-] = a× c; [HCN] = c - a× c = с(1-a).
Подставим эти величины в выражение для константы диссоциации
Кдис.HCN = 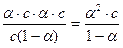 .
.
Цианистоводородная кислота имеет очень малую степень диссоциации a<1  и 1-a » 1. Тогда Кдис.HCN =a2 × c.
и 1-a » 1. Тогда Кдис.HCN =a2 × c.
Для любого слабого электролита связь константы диссоциации и степени диссоциации выражается следующим уравнением:
Кдис. =a2 × c. 
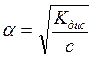
Это соотношение называется законом разбавления Оствальда: степень диссоциации возрастает при разбавлении раствора (уменьшении концентрации растворенного вещества).
Дата добавления: 2016-12-26; просмотров: 6478;
