Реакции солей в растворе. Гидролиз солей
Соль можно определить как соединение, которое образуется в результате реакции между кислотой и гидроксидом - реакции нейтрализации, но не является водой.
Некоторые соли при растворении в воде образуют нейтральные растворы (рН ≈ 7). Другие соли образуют кислые или щелочные растворы. Это обусловлено протеканием реакции между ионами соли и водой.
Гидролизом называется взаимодействие соли с водой, приводящее к образованию слабого электролита или труднорастворимого продукта.
Существует четыре типа солей.
1. Соль, образованная слабой кислотой и сильным гидроксидом (основанием). Примерами таких солей являются: ацетат натрия CH3COONa, карбонат калия К2СО3, сульфид натрия Na2S, цианид калия KCN.
Запишем молекулярное уравнение гидролиза соли KCN.
KCN + НОН ⇄ КОН + HCN
В уравнение реакции входят сильные электролиты - KCN и КОН и слабые электролиты - НОН и HCN.
Ионно-молекулярный вид этого уравнения
K+ + CN− + НОН ⇄ К+ + ОН− + HCN
Окончательный вид уравнения гидролиза:
CN− + НОН ⇄ ОН− + HCN
В этом случае гидролизу подвергается анион соли (кислотный остаток).
В результате реакции образовался слабый электролит - HCN. В свободном виде в растворе образуются гидроксид-ионы ОН−, которые обусловливают щелочную реакцию данного раствора (рН > 7).
Если в состав соли входит многозарядный ион, например Na2СО3, то в результате гидролиза образуются кислые соли:
Na2CO3 + НОН ⇄ NaOH + NaHCO3
карбонат натрия гидрокарбонат натрия
2Na+ + CO32− + НОН ⇄ Na+ + ОН− + Na+ + HCO3−
CO32− + НОН ⇄ ОН− + HCO3−
В таких солях гидролиз идет, как правило, только по первой ступени. До образования слабой кислоты Н2СО3 дело, как правило, не доходит из-за образования в растворе свободных ОН−-ионов.
2. Соль, образованная слабым гидроксидом и сильной кислотой. Примерами таких солей могут служить: хлорид аммония NH4Cl, сульфат железа (II) FeSO4.
NH4Cl + HOH ⇄ NH4OH + HCl
NH4+ + Cl− + HOH ⇄ NH4OH + H+ + Cl−
NH4+ + HOH ⇄ NH4OH + H+
В этом случае гидролизу подвергается катион соли. В результате реакции образовался слабый электролит NH4OH. В свободном виде в растворе находятся катионы водорода H+, которые определяют кислую реакцию данного раствора (рН< 7).
Если в состав соли входит многозарядный ион, то образуются основные соли:
AlBr3 + HOH ⇄ AlOHBr2 + HBr или
бромид алюминия гидроксобромид
алюминия
Al3+ + HOH ⇄ AlOH2+ + H+
При большом количестве воды гидролиз частично идет дальше
AlOHBr2 +НОН ⇄ Al(OH)2Br + HBr или
дигидроксобромид
алюминия
AlOH2+ +НОН ⇄ Al(OH)2+ + H+
До образования свободного гидроксида алюминия Al(OH)3 дело, как правило, не доходит вследствие накопления в растворе ионов H+.
3. Соль, образованная слабым гидроксидом и слабой кислотой. К такому типу солей относятся ацетат аммония CH3COONH4, сульфид алюминия Al2S3.
В этом случае гидролизу подвергаются и катион, и анион соли, в результате образуются два слабых электролита.
CH3COONH4 + НОН ⇄ CH3COOН + NH4ОН
CH3COO− + NH4+ + НОН ⇄ CH3COOН + NH4ОН
Реакция среды в данном случае зависит от относительной силы кислоты и основания. В случае их равной силы, как в приведенном примере, она может быть и нейтральной (рН ≈ 7).
4. Соль, образованная сильным гидроксидом и сильной кислотой. К этому типу солей относятся хлорид натрия NaCl , нитрат калия KNO3 и т.п.
Соли этого типа гидролизу не подвергаются, т.к. в воде они полностью диссоциируют, а образующиеся ионы не вступают в реакцию с водой. В результате не происходит ни образования слабого электролита, ни накопления ионов Н+ или ОН−. Растворы этих солей нейтральны (рН = 7).
Константа и степень гидролиза
Гидролиз – обратимый процесс, для которого может быть написано выражение константы равновесия. Например, для случая гидролиза цианида калия
KCN + HOH ⇄ KOH + HCN
константа равновесия будет
Кравн.= 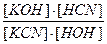 .
.
Если записать уравнение гидролиза в сокращенном молекулярно-ионном виде
CN- + HOH ⇄ OH- + HCN,
то константа равновесия этого процесса будет
Кравн.= 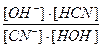 .
.
В разбавленных растворах концентрация воды представляет собой практически постоянную величину. Величина Кравн. × [HOH] для каждой гидролизующейся соли при заданной температуре будет величиной постоянной, обозначается Кгидр. и называется константой гидролиза данной соли.
Кгидр. = Кравн. × [HOH].
Окончательное выражение для константы гидролиза примет вид:
Кгидр.= 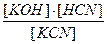 , или в сокращенном виде Кгидр. =
, или в сокращенном виде Кгидр. = 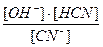 .
.
Величина константы гидролиза характеризует способность соли подвергаться гидролизу. При одинаковых температуре и концентрациях соли чем больше Кгидр., тем в большей степени гидролиз протекает.
Константа гидролиза связана с константой диссоциации слабых электролитов следующими зависимостями.
Для солей, образованных сильным гидроксидом и слабой кислотой (например, KCN):
Кгидр. = КН2О / Кдис. кислоты .
Для солей, образованных сильной кислотой и слабым гидроксидом (например, NH4Cl):
Кгидр. = КН2О / Кдис. гидроксида .
Очевидно, что чем слабее кислота (для первого случая)и чем слабее гидроксид(для второго случая), тем в большей степени подвергаются гидролизу их соли.
Для солей, образованных слабой кислотой и слабым гидроксидом
(например, СН3СООNH4):
Кгидр. = КН2О /(Кдис. гидроксида × Кдис. гидроксида).
Степенью гидролиза h называется доля электролита (соли), подвергшаяся гидролизу.
Обозначим исходную концентрацию соли, вступающую в реакцию гидролиза ссоли , моль/л.
Степень гидролиза связана с константой гидролиза следующим соотношением:
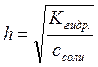
Для солей слабых кислот и сильных гидроксидов
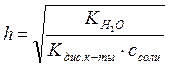 .
.
Для солей слабых гидроксидов и сильных кислот
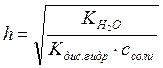 .
.
Гидролиз усиливается при нагревании раствора и при разбавлении (увеличении количества воды).
Рассчитать рН гидролизующихся солей можно по формулам:
а) для солей, образованных сильным гидроксидом и слабой кислотой
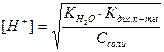 ;
;
б) для солей, образованных слабым гидроксидом и сильной кислотой
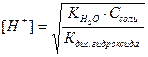 .
.
Дата добавления: 2016-12-26; просмотров: 1993;
