Химические свойства.
Для структуры фенола характерно взаимодействие неподеленной пары электронов атома кислорода и p-электронов ароматического кольца. Результатом этого является смещение электронной плотности с гидроксильной группы на кольцо, при этом связь О–Н становится более полярной, а значит, менее прочной (фенолы проявляют свойства слабых кислот).
Гидроксильная группа по отношению к бензольному кольцу является заместителем I рода, ориентируя реакции замещения в орто- и пара-положения.
Реакции фенола можно разделить на две группы: реакции с участием функциональной группы и реакции с участием ароматического кольца.
Реакции по гидроксильной группе
1. Кислотные свойства:
2C6H5OH + 2Na ® H2 + 2C6H5ONa (фенолят натрия);
C6H5OH + NaOH ® C6H5ONa + H2O;
C6H5ONa + H2O + CO2 ® C6H5OH + NaHCO3
(кислотные свойства фенола слабее, чем угольной кислоты);
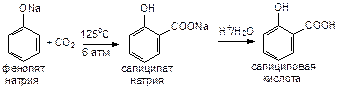
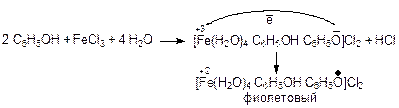
Фиолетовое окрашивание растворов в присутствии хлорида железа(III) – качественная реакция на фенолы.
В том случае, когда гидроксильная группа не связана непосредственно с ароматическим циклом, а находится в составе заместителя, влияние бензольного кольца на функциональную группу ослабевает и кислотные свойства не проявляются (класс ароматических спиртов). Например, бензиловый спирт реагирует с натрием и не реагирует с NaOH.
2. Образование сложных и простых эфиров (в отличие от спиртов фенолы не реагируют с карбоновыми кислотами, сложные эфиры получают косвенным путем – из хлорангидридов кислот и фенолятов): С6Н5ОН + СН3СООН ¹
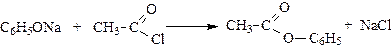
C6H5ONa + R–Br ® C6H5OR + NaBr
3. Окисление (фенолы легко окисляются даже под действием кислорода воздуха, поэтому при стоянии постепенно окрашиваются в розовый цвет):
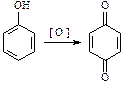
| 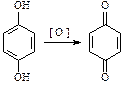
|
| бензохинон |
Реакции по бензольному кольцу.
1. Галогенирование:
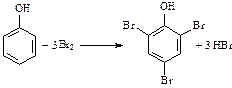
(в отличие от бензола и его гомологов фенол обесцвечивает бромную воду).
2. Нитрование:
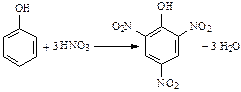
Тринитрофенол (пикриновая кислота) – кристаллическое вещество желтого цвета, по силе приближается к неорганическим кислотам).
3. Поликонденсация (взаимодействие с формальдегидом и образование фенолформальдегидных смол):
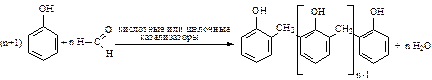
Получение фенола
3. Перегонка каменноугольной смолы.
4. Получение фенола из галогенбензолов:
С6Н5Сl + 2NaOH 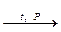 C6H5ONa + NaCl + H2O;
C6H5ONa + NaCl + H2O;
C6H5ONa + HCl ® C6H5OH + NaCl.
5. Каталитическое окисление изопропилбензола (кумола) – кумольный метод:
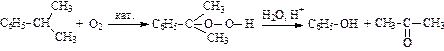 .
.
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны относятся к карбонильным соединениям и содержат карбонильную группу 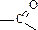 . В альдегидах карбонильная группа обязательно связана с атомом водорода (находится в положении 1 углеродной цепи), в кетонах она расположена в середине цепи и связана с двумя атомами углерода. Общая формула альдегидов и кетонов С2H2nO (межклассовые изомеры). Для альдегидов существует только изомерия углеродного скелета, для кетонов – изомерия углеродного скелета и изомерия положения функциональной группы.
. В альдегидах карбонильная группа обязательно связана с атомом водорода (находится в положении 1 углеродной цепи), в кетонах она расположена в середине цепи и связана с двумя атомами углерода. Общая формула альдегидов и кетонов С2H2nO (межклассовые изомеры). Для альдегидов существует только изомерия углеродного скелета, для кетонов – изомерия углеродного скелета и изомерия положения функциональной группы.
Номенклатура альдегидов и кетонов:
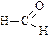
| 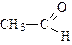
| 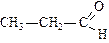
| |
| метаналь (формальдегид или муравьиный альдегид) | этаналь (ацетальдегид или уксусный альдегид) | пропаналь (пропионовый альдегид) | |
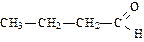
| 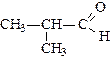
| 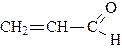
| |
| бутаналь (масляный альдегид) | метилпропаналь (изомасляный альдегид) | пропеналь (акролеин) | |
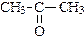
| 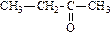
| 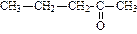
| |
| пропанон (диметилкетон или ацетон) | бутанон (метилэтилкетон) | пентанон-1 (метилпропилкетон) | |
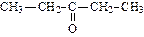
| 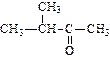
| 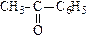
| |
| пентанон-2 (диэтилкетон) | метилбутанон (метилизопропил кетон) | метилфенилкетон (ацетофенон) | |
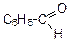
| 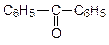
| ||
| бензойный альдегид | дифенилкетон (бензофенон) | ||
Дата добавления: 2016-11-02; просмотров: 1934;
