Химические свойства
1. Основные свойства. Атом азота в аммиаке и аминах имеет неподеленную пару электронов, способную присоединять ионы водорода за счет донорно-акцепторного взаимодействия. Амины, как и аммиак, обладают свойствами оснований, их растворы имеют щелочную реакцию:
CH3–NH2 + Н2О ® CH3–NH3+ ОН–
метиламин гидроксид метиламмония
CH3–NH2 + НСl ® CH3–NH3+ Cl–
метиламин хлорид метиламмония (соль)
Предельные амины – более сильные основания, чем аммиак; вторичные амины сильнее первичных. Соли аминов разлагаются при действии сильных неорганических оснований:
CH3–NH3Cl + NaOH ® CH3–NH2 + NaСl + H2O.
Ароматические амины (анилин) гораздо слабее аммиака и алифатических аминов. Это связано с тем, что неподеленная пара электронов атома азота частично смещена к ароматическому кольцу за счет сопряжения с p-электронами бензольного кольца и поэтому менее доступна для взаимодействия с протоном:
С6H5NH2 + H2O ¹ ; C6H5NH2 + HCl ® C6H5NH3+ Cl–
анилин хлорид фениламмония
2. Горение аминов. Горение аминов не сопровождается выделением оксидов азота, а лишь азота в виде простого вещества:
4CH3NH2 + 9O2 ® 4CO2 + 10H2O + 2N2 или
CnH2n+3N + (1,5n+0,75)O2 ® nCO2 + (n+1,5)H2O + 0,5N2.
3. Взаимодействие аминогруппы анилина с бензольным кольцом. Аминогруппа – заместитель I рода, облегчающий реакции электрофильного замещения атомов водорода бензольного кольца и ориентирующий их в орто- и пара-положения. Анилин обесцвечивает бромную воду. При этом образуется белый осадок триброманилина – качественная реакция на ароматические амины:
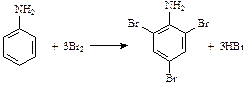
Получение аминов
Амины чаще всего получают восстановлением нитросоединений:
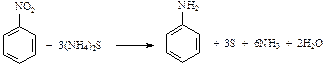 (реакция Зинина)
(реакция Зинина)
С6H5NO2 + 3Fe + 7HCl ® C6H5NH3+ Cl– + 3FeCl2 + 2H2O
C6H5NH3+ Cl– + NaOH ® C6H5NH2 + NaСl + H2O
или в общем виде R–NO2 + 6[H] ® R–NH2 + 2H2O
Амины в природе
Этаноламин (коламин) HOCH2CH2NH2 является структурным компонентом сложных липидов. Холин HOCH2CH2N+(CH3)2 – структурный компонент фосфолипидов; витаминоподобное вещество, регулирующее жировой обмен; предшественник в биосинтезе ацетилхолина. Ацетилхолин CH3COOCH2CH2N+(CH3)2 - посредник при передаче нервных импульсов (нейромедиатор). Накопление ацетилхолина в организме приводит к непрерывной передаче нервных импульсов и сокращению мускульной ткани. На этом основано действие нервнопаралитических ядов (зарин,табун), которые ингибируют действие фермента ацетилхолинэстеразы, катализирующего расщепление ацетилхолина. Катехоламины–дофамин, норадреналин, адреналин – биогенные амины, продукты метаболизма аминокислоты фенилаланина.
СПИРТЫ
Спирты – органические соединения, содержащие одну или несколько гидроксильных групп, соединенных с углеводородным радикалом. Функциональная группа – ОН. Число гидроксильных групп определяет атомность спирта.
Одноатомные предельные спирты
Одноатомные предельные спирты содержат одну гидроксильную группу, соединенную с предельным углеводородным радикалом. Общая формула: R–OH, CnH2n+1OH, CnH2n+2O. Для спиртов характерны изомерия положения функциональной группы и изомерия углеродного скелета.
Спирты, в которых гидроксильная группа находится в положении 1 (присоединена к первичному атому углерода), называются первичными. Если гидроксильная группа расположена в середина цепи (присоединена к вторичному атому углерода), то спирт называется вторичным. Присоединение гидроксильной группы к третичному атому углерода приводит к образованию третичных спиртов.
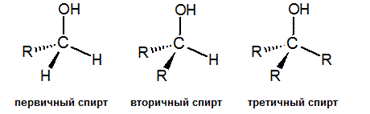
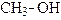
| 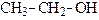
| 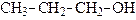
| |||
| метанол (метиловый спирт) | этанол (этиловый спирт) | пропанол-1 (н-пропиловый спирт) | |||
| (п е р в и ч н ы е) | |||||
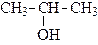
| 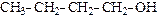
| 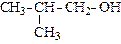
| |||
| пропанол-2 (изопропиловый спирт) | бутанол-1 (н-бутиловый спирт) | метилпропанол-1 изобутиловый спирт) | |||
| (вторичный) | (п е р в и ч н ы е) | ||||
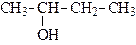
| 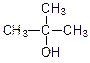
| ||||
| бутанол-2 (втор-бутиловый спирт) | метилпропанол-2 (трет-бутиловый спирт) | ||||
| (вторичный) | (третичный) | ||||
Физические свойства. Низшие спирты, содержащие менее 12 атомов углерода, – жидкости, температуры кипения которых значительно выше температур кипения соответствующих алканов. Причиной этого является образование водородных связей за счет полярности связи О–Н и наличия собственных (неподеленных) пар электронов атомов кислорода. За счет образования водородных связей спирты с небольшим числом атомов углерода в цепи хорошо растворимы в воде.
Химические свойства. Особенности химических свойств спиртов определяются наличием функциональной группы ОН. Электроотрицательный атом кислорода оттягивает на себя общие электронные пары, приобретая при этом отрицательный заряд, а соседние атомы углерода и водорода получают положительные заряды. Смещение электронных пар приводит к образованию полярных связей, менее прочных и более реакционноспособных.
Основные химические реакции предельных одноатомных спиртов:
Реакции, протекающие с разрывом связи RО–Н
а). Кислотные свойства спиртов:
2С2H5OH + 2Na ® H2+ 2C2H5ONa
этилат натрия (алкоголят);
С2H5ONa + Н2O ® С2H5OH + NaOH
(гидролиз алкоголятов);
С2H5OH + NaОН ¹ (одноатомные спирты не реагируют со щелочами).
б). Образование сложных эфиров с органическими и неорганическими кислотами:
С2H5OH + СН3СООН 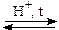 Н2О + СН3СООС2Н5
Н2О + СН3СООС2Н5
(этилацетат);
С2H5OH + HNO3 (HO–NO2)  Н2О + С2Н5ОNO2.
Н2О + С2Н5ОNO2.
Реакции, протекающие с разрывом связи R–ОН
а). Замещение гидроксильной группы на галоген (проявление слабых основных свойств): С2H5OH + HCl ® C2H5Cl + H2O;
б). Внутримолекулярная дегидратация:
СH3–СН2–OH 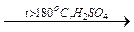 H2O + СН2=СН2
H2O + СН2=СН2
(получение алкенов);
СH3–СН2–СН(OH)–СН3 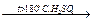 СH3–СН=СН–СH3 + H2O
СH3–СН=СН–СH3 + H2O
(реакция протекает по правилу Зайцева – водород уходит от наименее гидрированного атома углерода).
в). Межмолекулярная дегидратация (получение простых эфиров):
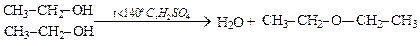
(диметиловый эфир).
Простые эфиры образуют самостоятельный класс органических соединений общей формулы CnH2n+2O, который изомерен классу предельных одноатомных спиртов (межклассовая изомерия).
Реакции окисления одноатомных спиртов
а). Горение: СnH2n+2O + (1,5n +0,5)O2 ® nCO2 + (n +1)H2O.
б). Окисление кислородом воздуха в присутствии катализаторов:
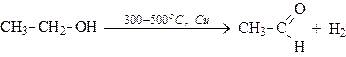
(первичный спирт) (альдегид)
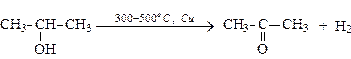
(вторичный спирт) (кетон)
в). Окисление оксидом меди (II):
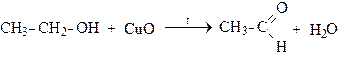
(первичный спирт) (альдегид)
г). Окисление перманганатом калия или дихроматом калия при комнатной температуре (первичные спирты окисляются до карбоновых кислот; вторичные спирты – до кетонов; третичные спирты в указанных условиях не окисляются):
5СH3OH+6KMnO4+9H2SO4 ® 5CO2+6MnSO4+3K2SO4+19H2O;
5СH3–СН(OH)–СН3+2KMnO4+3H2SO4®
5СH3–СO–СН3+2MnSO4+K2SO4+8H2O.
Одноатомные непредельные спирты
Непредельные спирты (алкенолы и алкинолы) — производные непредельных углеводородов, в молекулах которых водородный атом замещен на гидроксильную группу.
Например,
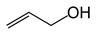
| 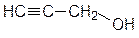
| 
|
| пропенол-1 (аллиловый спирт) | пропинол-1 (пропаргиловый спирт) | 3-фенилпропенол-1 (коричный спирт) |
Структурная изомерия непредельных спиртов связана со строением углеродной цепи и положением в ней кратной связи и гидроксильной группы.
Непредельные спирты, в которых гидроксильная группа находится непосредственно при углеродном атоме с двойной связью (этиленовые спирты или енолы), неустойчивы и в свободном состоянии не встречаются. В растворах они могут существовать непродолжительное время, изомеризуясь затем в более стабильную форму — альдегиды или кетоны:
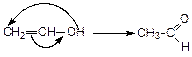
виниловый спирт этаналь
Непредельные спирты, имея в молекуле кратную связь и гидроксильную группу, проявляют свойства спиртов и непредельных соединений.
Дата добавления: 2016-11-02; просмотров: 2239;
