Опыт 6. Восстановительные свойства солей хрома (III)
В пробирку с тетрагидроксохроматом (III) натрия, полученным в опыте 4, прибавить 3-5 капель раствора пероксида водорода (Н2О2). Нагреть смесь на водяной бане или очень осторожно подержать над пламенем спиртовки. Нагревание продолжать до изменения зеленой окраски.
- Отметить изменение окраски раствора на ………………..
- Составить уравнение реакции, учитывая, что образуется хромат натрия:
Na[Cr(OH)4] + NaOH + H2O2 → Na2CrO4 + H2O
Зеленый желтый
- Тетрагидроксохромат (III) натрия проявляет ………………………свойства
пероксид водорода (Н2О2) ……………………….свойства
- Рассчитать ЭДС реакции: ЭДС = φок . – φвос. =
Вывод:
Опыт 7. Условия сосуществования в растворе хромата и дихромата
А) Переход хромата в дихромат.
В пробирку прилить 2-3 капли раствора хромата калия или натрия (K2CrO4 или Na2CrO4) и сюда же прилить 4-5 капель раствора серной кислоты.
- Отметить изменение окраски раствора при добавлении кислоты
- Написать уравнение реакции превращения хромата в дихромат в молекулярной и ионной форме.
Na2CrO4 + H2SO4 →
- при добавлении кислоты равновесие смещается ……………, в сторону образования …………….
Б) Переход дихромата в хромат.
В пробирку прилить 3-4 капли дихромата калия и сюда же прилить по каплям раствор щелочи до изменения цвета раствора.
- Отметить изменение окраски раствора при добавлении щелочи
- Написать уравнение реакции превращения дихромата в хромат в молекулярной и ионной форме.
K2Cr2O7 + NaOH →
- при добавлении щелочи равновесие смещается ……………, в сторону образования …………….
Опыт 8. Окислительные свойства солей хрома (VI)
В пробирку прилить пипеткой 6-7 капель раствора дихромата калия, 2-3 капли раствора серной кислоты и 1-2 капли иодида калия (KI). Далее к этому раствору прилить 3 – 4 капли раствора тиосульфата натрия Na2S2O3 для обесцвечивания окраски выделившегося йода.
- Отметить изменение цвета раствора
- Составить уравнение реакции, учитывая, что образуются сульфат хрома(), йод:
K2Cr2O7 + KI + H2SO4 → Cr2(SO4)3 + I2 + …..
- Указать окислитель…………., восстановитель…………………..;
- Рассчитать ЭДС реакции: ЭДС = φок . – φвос. =
- Составить уравнение реакции йода с тиосульфатом натрия:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
- Отметить цвет раствора после добавления Na2S2O3………………..
- Сделать вывод о свойствах дихромата калия.
Цель работы:
- Изучить свойства металлов VIIБ – подгруппы;
- Изучить свойства характеристичных соединений металлов VIIБ – подгруппы.
Краткая теория.
1. Положение элементов в периодической системе, свойства атомов
Электронные конфигурации атомов, валентные электроны металлов VIIБ- подгруппы:
Степени окисления: VIIБ - подгруппа …………..……..…….
2. Свойства простых веществ – металлов:
- положение в «ряду стандартных окислительно-восстановительных (электродных) потенциалов металлов»
φ(Men+/Me) =
- активность металлов:
- пассивирование металлов……..
Составьте уравнения реакций:
- взаимодействие с кислородом:
а) Mn
- взаимодействие с галогенами (хлором):
а) Mn
- взаимодействие с серой:
а) Mn
- взаимодействие с водой термодинамически невозможно для металла…………..
- взаимодействие с водой для металла………….. термодинамически возможно, однако он устойчив в воде так как…………………….
- взаимодействие с водными растворами кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими):
а) Mn + HBr →
б) Mn + H2SO4(разб) →
- взаимодействие с концентрированной H2SO4:
а) Mn + H2SO4(конц) → ………….+ S + H2O
б) Mn + H2SO4(конц) → ………….+ H2S + H2O
- взаимодействие с разбавленной и концентрированной HNO3:
а) Mn + HNO3(разб) → ………….+ N2O + H2O
б) Mn + HNO3(конц) → ………….+ NO2 + H2O
3. Свойства оксидов и гидроксисоединений металлов VIIБ - подгруппы:
- формулы оксидов металлов VIIБ - подгруппы ……………………………………….
- формулы гидроксисоединений металлов VIIБ - подгруппы ……………………………
- растворимость, взаимодействие с водой оксидов и гидроксисоединений металлов VIIБ - подгруппы
- диссоциация в водном растворе гидроксида марганца(II):
- диссоциация в водном растворе марганцовой кислоты:
Основные свойства проявляют оксид и гидроксид марганца ………….
Амфотерные свойства проявляют оксид и гидроксид марганца ………….
Кислотные свойства проявляют соединения марганца:………….
- взаимодействие оксидов и гидроксидов металлов VIIБ - подгруппы с кислотами и кислотными оксидами.
а) MnO + H2SO4 →
б) Mn(OH)2 + H2SO4 →
- взаимодействие оксидов и гидроксидов металлов VIIБ - подгрупп с основаниями при сплавлении происходит с образованием простых солей (назовите их) и воды
MnO2 + NaOH → ….. + H2O
Mn2O7 + NaOH → NaMnO4 + H2O
HMnO4 + NaOH → NaMnO4 + H2O
4. Растворимость солей, гидролиз солей
Плохо растворимы соли марганца(II)………….
Растворимый сульфат марганца(II) подвергается гидролизу по …………….., среда в растворе …………………….
5. Окислительно-восстановительные свойства соединений металлов VIБ - подгруппы
- Используя значения ОВП, приведенных на диаграмме Латимера, охарактеризовать окислительно-восстановительные свойства соединений марганца.
Укажите соединения, проявляющие
а) только окислительные свойства………
б) только восстановительные свойства…….
в) двойственные окислительно-восстановительные свойства…….
г) диспропорционируют в кислой среде манганаты (MnO42-) и соединения (Mn3+).
3MnO42- + 4H+ → 2MnO4- + MnO2 + 2H2O
2Mn3+ + 2H2O → Mn2+ + MnO2 + 4H+
Диаграмма Латимера для марганца (в кислой среде):
+ 1,51
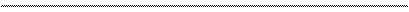
+0,564 2,26 +0,95 +1,51 – 1,18
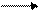




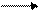
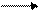
 MnO4- MnO42- MnO2 Mn3+ Mn2+ Mn
MnO4- MnO42- MnO2 Mn3+ Mn2+ Mn

 +1,70 + 1,23
+1,70 + 1,23
Диаграмма Латимера для марганца (в щелочной среде):
+0,564 +0,60 +0,15 - 0,25 – 1,55
 MnO4- MnO42 - MnO2 Mn(OH)3 Mn(OH)2 Mn
MnO4- MnO42 - MnO2 Mn(OH)3 Mn(OH)2 Mn
 |  | ||||||
 |  | ||||||

 +0,588 - 0,05
+0,588 - 0,05
Окислительные свойства соединений………………более выражены в …………………. среде
Восстановительные свойства соединений……………более выражены в …………………. среде
Опыт 1. Получение и свойства гидроксида марганца(II)
В две пробирки внести по 2 капли раствора сульфата марганца.(II) и 2 н раствора гидроксида натрия до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида марганца(II) добавить избыток раствора соляной кислоты, во вторую пробирку – избыток раствора гидроксида натрия:
– охарактеризовать внешний вид осадка…..
- составить уравнения реакции образования гидроксида марганца (II) в молекулярной и ионной форме
MnSO4 + NaOH →
- отметить, с каким раствором - соляной кислоты или гидроксида натрия - взаимодействует гидроксид марганца (II)….
- составить уравнение реакции гидроксида марганца (II) с соляной кислотой в молекулярной и ионной форме
Mn(OH)2 + HCl →
- отметить, как изменяется внешний вид осадка Mn(OH)2 во второй пробирке при хранении на воздухе……
- составить уравнение реакции окисления гидроксида марганца (II) на воздухе
Mn(OH)2 + O2 + … →
- сделать вывод о свойствах гидроксида марганца (II):
Дата добавления: 2016-09-20; просмотров: 4604;
