В две пробирки внести раздельно по 5-6 капель бромной и иодной воды. В обе пробирки добавить по несколько капель тиосульфата натрия до обесцвечивания растворов.
- Отметить происходящие изменения в пробирках
- Составить уравнение реакции, учитывая, что бром окисляет тиосульфат до сульфата, при этом в реакции участвует вода. Выделяющаяся сера является продуктом побочной реакции.
Na2S2O3 + Br2 + H2O → Na2SO4 + H2SO4 + HBr
- Указать окислитель………………….., восстановитель ………………….
- Составить уравнение реакции, учитывая, что йод окисляет тиосульфат до тетратионата Na2S4O6.
Na2S2O3 + I2 → Na2S4O6 + NaI
- Указать окислитель………………….., восстановитель ………………….
- указать, какие свойства проявляет тиосульфат натрия.
Лабораторная работа № 13
на тему: «Химические свойства неметаллов
V-А подгруппы (N,P) и их соединений.
Химические свойства неметаллов
VI-А подгруппы (C, Si) и их соединений.
Цель работы:
- Изучить свойства неметаллов VА – подгруппы;
- Изучить свойства характеристичных соединений неметаллов VА – подгруппы.
Краткая теория.
1. Положение элементов в периодической системе, свойства атомов
Электронные конфигурации атомов, валентные электроны неметаллов VА- подгруппы:
Степени окисления: VА - подгруппа …………..……..…….
2. Свойства простых веществ – неметаллов VА – подгруппы:
- физические свойства:
Составьте уравнения реакций:
- взаимодействие с кислородом:
а) N2 б) P
- взаимодействие азота и фосфора с металлами:
а) N2 + Mg → б) Zn + P →
- азот, фосфор в воде ………………растворимы;
- в водных кислых растворах кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими) азот, фосфор ……………………
- взаимодействие с концентрированной H2SO4:
а) P + H2SO4(конц) → SO2 + H2O
- взаимодействие с концентрированной HNO3:
б) P + HNO3(конц) → ………….+ NO2 + H2O
3. Свойства соединений с водородов и их солей:
Формулы и названия соединений с водородом……………
- агрегатные состояния соединений с водородом ………………
- растворимость соединений с водородом в воде ……………….
- растворы соединений с водородом в воде называют:
NH3 - ……………………
- Сравните основные свойства в ряду кислот: NH3 PH3
4. Свойства оксидов и кислородсодержащих кислот азота и фосфора:
- формулы оксидов ……………………………………….
- составьте формулы кислородсодержащих кислот ……………………………
- назовите кислородсодержащие кислоты азота и фосфора и их соли:
- растворимость, взаимодействие с водой оксидов азота
NO2 + H2O →
N2O5 + H2O →
- растворимость, взаимодействие с водой оксидов фосфора
P2O5 + H2O →
- диссоциация в водном растворе кислородсодержащих кислот азота
HNO2 →
HNO3 →
Слабые кислотные свойства проявляют соединения азота:………….
Слабые кислотные свойства проявляют соединения фосфора:………….
Сильные кислотные свойства проявляют соединения азота:………….
- взаимодействие оксидов и кислот азота и фосфора с основаниями
NO2 + NaOH → ……… + ……. + H2O
N2O3 + NaOH → ……….. + H2O
N2O5 + NaOH → ……….. + H2O
- Сравните кислотные свойства в ряду кислот:
– HNO2 - HNO3……...
- Сравните кислотные свойства в ряду кислот:
– H3PO4 …………………..– HNO3 …………. ………...
5. Растворимость солей, гидролиз солей
Плохо растворимы ортофосфаты………….
нитриты……………………………….нитраты………………………….
Растворимые нитриты и ортофосфаты подвергается гидролизу по …………….., среда в растворе …………………….
Растворимые соли аммония подвергаются гидролизу по …………..………….., среда в растворе …………………….
- Сравните гидролизуемость солей в ряду: K3PO4 - KNO2 – KNO3 ……...
6. Окислительно-восстановительные свойства соединений азота и фосфора
- Используя значения ОВП, приведенных на диаграмме Латимера, охарактеризовать окислительно-восстановительные свойства соединений.
Диаграмма Латимера для азота:
а) в кислой среде
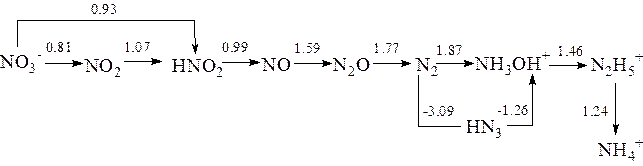 б) в щелочной среде
б) в щелочной среде
-0,86 + 0,88 -0,46 +0,76 +0,94 -3,4
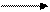
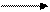
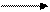 NO3- N2O4 NO2- NO N2O N2 N3-
NO3- N2O4 NO2- NO N2O N2 N3-
 (NO2)
(NO2)
+0,16 +0,73 -2,86
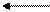
 NH3 N2H4 NH2OH
NH3 N2H4 NH2OH
- Укажите соединения азота, проявляющие
а) только окислительные свойства………
б) только восстановительные свойства…….
в) двойственные окислительно-восстановительные свойства…….
- Укажите и сравните окислительные свойства в ряду кислот:
– H3PO4 ……………..– HNO2 ……..………. - HNO3……...
Дата добавления: 2016-09-20; просмотров: 2953;
